
【题目】实验室中H2SO4、NaOH是两种常见试剂。
(1)现在实验室中有一瓶98%的H2SO4(ρ=1.84g/cm3)。
①该硫酸的物质的量浓度为____________mol/L;
②现要配置2.0mol/L的稀H2SO4250mL,请回答如下问题:需要量取浓硫酸的体积为________(保留一位小数).在该实验使用的玻璃仪器中除烧杯、玻璃棒、胶头滴管、量筒外,还有__________。
(2)有一瓶氢氧化钠固体由于放置时间较长,某同学怀疑其由于吸收空气中CO2而发生部分变质。为证明此推测,进行如下实验。
称取2.000g样品,配制成250mL待测液。量取20.00mL待测液,当慢慢滴入0.100mol/L的硫酸溶液18.60mL时测得溶液正好显中性.根据实验数据可知:
待测溶液中氢氧化钠的浓度为_____________mol/L;
样品中氢氧化钠的质量百分数为______________。
由此,该同学得出结论:样品已部分变质.
①请你对实验进行评价(假定实验操作过程准确无误):_________
A.该实验不能证明关于“部分变质”的推测
B.该实验可以证明关于“部分变质”的推测
C.若样品中混有少量氢氧化钾,也能使其质量百分数变小
②在用氢氧化钠固体配制溶液过程中,下列操作中也会造成氢氧化钠质量百分数偏小的是________(填字母)。
A.在称量时,把氢氧化钠样品放在称量纸上进行称量
B.在溶解过程中,有少量液体溅出
C.在转移过程中,烧杯和玻璃棒没有进行洗涤
D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线水平
【答案】18.4 27.2 250mL容量瓶 0.143 71.25% BC ABCD
【解析】
(1)①根据c=![]() 计算;②根据溶液稀释前后物质的量不变即c(稀)V(稀)=c(浓)V(浓)计算所需浓硫酸的体积;根据配制步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作选择仪器;
计算;②根据溶液稀释前后物质的量不变即c(稀)V(稀)=c(浓)V(浓)计算所需浓硫酸的体积;根据配制步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作选择仪器;
(2)慢慢滴入硫酸溶液18.60ml时,测得溶液正好显中性,说明恰好生成Na2SO4,根据钠守恒和质量守恒列式计算解出NaOH、Na2CO3的物质的量,然后求出氢氧化钠的物质的量浓度以及质量百分数;①根据上述计算结果分析判断;②根据c=![]() 分析判断。
分析判断。
(1)①浓H2SO4的物质的量浓度c(H2SO4)=![]() =
=![]() =18.4mol/L,故答案为:18.4;
=18.4mol/L,故答案为:18.4;
②根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×2.0mol/L,解得:x≈27.2,所以量取的浓硫酸体积是27.2mL;配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管),在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,则缺少仪器250mL容量瓶,故答案为:27.2;250mL容量瓶;
(2)慢慢滴入0.1000mol/L的硫酸溶液18.60mL时,硫酸的物质的量为0.001860mol,测得溶液正好显中性,说明溶液中只有溶质Na2SO4,其物质的量为0.001860mol,设20.00mL待测液中NaOH、Na2CO3的物质的量分别为xmol、ymol,根据钠守恒有xmol+ymol×2=0.001860mol×2,根据质量守恒有40x+106y=2.000g×![]() ,解得:x=0.00286mol、y=0.00043mol,氢氧化钠的质量为0.00286mol×40g/mol=0.1144g,物质的量浓度
,解得:x=0.00286mol、y=0.00043mol,氢氧化钠的质量为0.00286mol×40g/mol=0.1144g,物质的量浓度![]() =0.143moL/mol,样品中NaOH的质量百分数为
=0.143moL/mol,样品中NaOH的质量百分数为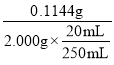 ×100%=71.25%,故答案为:0.143;71.25%;
×100%=71.25%,故答案为:0.143;71.25%;
①由上述计算结果可知,样品中混有少量碳酸钠,可以证明样品“部分变质”的推测;等质量的KOH和NaOH,KOH的物质的量小于NaOH,中和时,KOH需要硫酸的体积小于等质量的NaOH中和硫酸的体积,所以样品中混有少量氢氧化钾,会导致滴入的硫酸体积偏小,故C正确;故答案为:BC;
②A.在称量时,把氢氧化钠样品放在称量纸上进行称量,氢氧化钠具有吸湿性,易潮解,导致称出的氢氧化钠质量偏少,溶质的物质的量偏小,根据c=![]() 分析,氢氧化钠浓度减小,质量百分数偏小,故A正确;B.在溶解过程中,少量液体溅出,导致溶质的物质的量偏小,根据c=
分析,氢氧化钠浓度减小,质量百分数偏小,故A正确;B.在溶解过程中,少量液体溅出,导致溶质的物质的量偏小,根据c=![]() 分析,氢氧化钠浓度减小,质量百分数偏小,故B正确;C.在转移过程中,烧杯和玻璃棒没有进行洗涤,溶质的物质的量偏小,根据c=
分析,氢氧化钠浓度减小,质量百分数偏小,故B正确;C.在转移过程中,烧杯和玻璃棒没有进行洗涤,溶质的物质的量偏小,根据c=![]() 分析,氢氧化钠浓度减小,质量百分数偏小,故C正确;D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线水平,溶质的物质的量偏小,根据c=
分析,氢氧化钠浓度减小,质量百分数偏小,故C正确;D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线水平,溶质的物质的量偏小,根据c=![]() 分析,氢氧化钠浓度减小,质量百分数偏小,故D正确;故答案为:ABCD。
分析,氢氧化钠浓度减小,质量百分数偏小,故D正确;故答案为:ABCD。


科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、H2、CH3OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) ![]() H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g) ![]() H2 = -41 kJmol-1
H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) ![]() H3 = -660kJmol-1
H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g)![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②P1_____P2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制0.1mol/L的NaHCO3溶液250mL,完成下列步骤:
(1)用电子天平称取NaHCO3固体______________g;
(2)将称好的NaHCO3固体放入______________,加适量的蒸馏水将其___________;
(3)待溶液_____________后,将溶液沿着______________移入250mL容量瓶中,在操作过程中不能损失任何一点液体,否则会使溶液的浓度偏_________(高或低);
(4)用少量蒸馏水冲洗_______________2-3次,将洗涤液移入______________中;
(5)向容量瓶内加水至距离刻度线______________时,改用________________小心加水至___________________,若加水超过刻度线,会造成溶液浓度偏_________(高或低),应该_____________;
(6)最后盖好瓶盖,___________,然后将配好的溶液移入试剂瓶中,贴好标签。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为375%的浓盐酸密度为116 g/cm3配制250mL浓度为1mol/L的稀盐酸。试回答下列问题:
(1)配制稀盐酸时,应选用容量为______mL的容量瓶;
(2)经计算需要______ mL浓盐酸,在量取时宜选用下列量筒中的______。(填字母)
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释后的盐酸温度与室温一致后,沿玻璃棒将盐酸注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________________________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是__________(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是_______(填“偏高”、“偏低”、“无影响”)。
(5)配制完后,应将容量瓶中的稀盐酸转移到_______中存放,并贴上标签。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明: ![]() 不稳定,不考虑)
不稳定,不考虑)
请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知, ![]() ,则
,则![]() 和
和![]() 等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
(5)常温下, ![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() 的电离平衡常数Ka_______________。
的电离平衡常数Ka_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知CO2与碱溶液发生反应时,依次发生如下离子反应:CO2+2OH-→CO32-+H2O、CO2+CO32-+H2O→2HCO
(1)向含0.01mol氢氧化钙的石灰水中通入CO2,得到0.4g白色沉淀,则通入CO2的物质的量为______mol或______mol.
(2)现有NaOH和Ba(OH)2混合溶液100mL,已知该溶液中c(OH-)=1mol/L,向溶液中缓缓通入CO2气体(溶液体积变化忽略不计).
①当至少通入CO2气体体积为0.56L(标准状态)时生成的沉淀最多,则原溶液中氢氧化钠和氢氧化钡的物质的量浓度各为多少?__________________
②当通入的CO2气体总体积为2.24L(标准状态)时,溶液中阴离子(OH-除外)的物质的量浓度是多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )

A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1
C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D.F点收集到的CO2的量最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com