
【题目】已知2NaHCO3![]() Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
【答案】A
【解析】
n(Na+)=1.2molL﹣1×0.1L=0.12mol,根据题意可得2n(Na2CO310H2O)+n(NaHCO3)=0.12mol,n(Na2CO310H2O)×286g/mol+n(NaHCO3)×84g/mol=14.8g,解得n(Na2CO310H2O)=0.04mol,n(NaHCO3)=0.04mol。14.8g Na2CO310H2O和NaHCO3组成的固体混合物加热至恒重,0.04molNa2CO310H2O转化为0.04molNa2CO3,0.04molNaHCO3转化为0.02molNa2CO3,所以残留固体质量是(0.04+0.02)mol×106g/mol=6.36g,故选A


科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是重要的基本化工原料,广泛用于化学、冶金、造纸、纺织、医药、石油等工业,以及饮用水消毒、污水处理等方面。
(1)实验室制取Cl2的反应方程式为:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为_________;
Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为_________;
(2)KMnO4和盐酸反应也可制取Cl2:
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O
请配平该反应方程式。当标准状况下有11.2L氯气生成时,该反应转移电子的数目为_____。
(3)用氯氧化法可处理含KCN的废水。液氯在碱性条件下可以将氰化物氧化成毒性仅为氰化物的千分之一的氰酸盐,氰酸盐再进一步被氧化为无毒物质。
①由反应KCN+2KOH+Cl2 = KOCN + 2KCl+H2O判断,氰酸盐KOCN中C元素的化合价为_________(已知反应前后氮元素化合价未改变);
②投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移的方向和数目:
2KOCN+4KOH+ 3Cl2 = 2CO2↑ + N2 ↑+6KCl + 2H2O
______________________________
③若某厂废水中含KCN的浓度为0.65g/L,处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(3)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作,请在( )中填写所使用和除杂试剂的化学式,在![]() 中填写实验操作名称。写出符合下列条件的离子方程式
中填写实验操作名称。写出符合下列条件的离子方程式

(1)①___________ 、 ____________;②_______________________;③____________;④____________;⑤____________;⑥____________;⑦____________。
(2)除去Mg2+的离子方程式_______________________________________________
(3)除去SO42-的离子方程式______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O2 ![]() 2O3 。
2O3 。
(1)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为________L。
(2)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
Ⅰ.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131 kJ/mol
CO(g)+H2(g) ΔH=+131 kJ/mol
②CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH=a kJ/mol
CH4(g)+H2O(g) ΔH=a kJ/mol
查阅资料反应②中相关化学键键能数据如下表:
化学键 | C≡O | H-H | H-C | H-O |
E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)则反应②中a=______。
(2)煤直接甲烷化反应C(s)+2H2 (g)![]() CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1 mol CO2和2.5 mol H2,发生反应: 2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
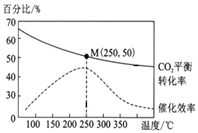
(3)图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是______。
(4)250℃时,该反应的平衡常数K值为______。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入1 molCO2和3 molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5)反应前1小时内的平均反应速率v(H2)为______mol/(L·h),该温度下CO2的平衡转化率为______。
Ⅳ.电解逆转化制乙醇
(6)科研人员通过反复实验发现:CO2可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在______极(填“阴”或“阳”),该电极的反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为海水综合利用的部分流程,下列有关说法正确的是
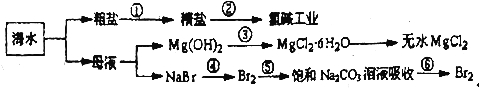
A. 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质加入的药品顺序为NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 第②步是一个将电能转化为化学能的过程,工业上可采用石墨为电极,采用阴离子交换膜的电解装置
C. 第③步中结晶出的MgC12·6H2O可在空气中受热分解制无水MgC12
D. 第④步中反应的离子方程式为C12+2Br-=2C1-+Br2,第④⑤步的目的是富集溴元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有等体积NH3、CO2、NO的混合气体依次通过盛有浓H2SO4、Na2O2和Na2CO3溶液的装置,充分作用后,最后得到的气体是( )
A. CO2和NOB. CO2C. NOD. NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com