
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
分析 (1)①反应速率v(CO2)=$\frac{△c(CO2)}{△t}$;平衡常数K=$\frac{[CO2]•[H2]}{[CO]•[H2O]}$;对于吸热反应,温度升高,平衡常数变大;对于放热反应,温度升高,平衡常数变小.②平衡转化率等于物质消耗的量与物质的起始量之比.
(2)①原电池负极发生氧化反应,失去电子.②电解池中阳极发生氧化反应,失去电子;电解池阴极发生还原反应,得到电子.可根据电子守恒来计算原电池及电解池相关的计算题.
解答 解:(1)①实验组i中,由H2O(g)+CO(g)?CO2(g)+H2(g)可知,在2L的恒容容器中,平衡时各物质的浓度分别为:[H2O]=0.2mol•L-1,[CO]=1.2mol•L-1,[CO2]=0.8mol•L-1,[H2]=0.8mol•L-1;所以反应速率v(CO2)=$\frac{[CO2]}{△t}$=$\frac{0.8mol•L-}{5min}$=0.16mol•L-1•min-1.在650℃下,平衡常数K1=$\frac{[CO2]•[H2]}{[CO]•[H2O]}$=$\frac{0.8mol•L-1×0.8mol•L-1}{0.2mol•L-1×1.2mol•L-1}$≈2.67;900℃时,平衡时各物质的浓度分别为:[H2O]=0.3mol•L-1,[CO]=0.8mol•L-1,[CO2]=0.2mol•L-1,[H2]=0.2mol•L-1,平衡常数K2=$\frac{0.2mol•L-1×0.2mol•L-1}{0.3mol•L-1×0.8mol•L-1}$≈0.17,温度升高,K2小于K1.
故答案为:0.16mol•L-1•min-1;减小.
②在实验组iii中,由H2O(g)+CO(g)?CO2(g)+H2(g)可知,在2L的恒容容器中,平衡时各物质的浓度分别为:[H2O]=$\frac{2-d}{2}$mol•L-1,[CO]=$\frac{1-d}{2}$mol•L-1,[CO2]=$\frac{d}{2}$mol•L-1,[H2]=$\frac{d}{2}$mol•L-1;在900℃时,K2=$\frac{(2-d)•(1-d)}{{d}^{2}}$=0.17,解得d=0.4,由等量关系可得c=1-0.4=0.6;达平衡时实验组ii中H2O(g)的转化率αii (H2O)=$\frac{0.4mol}{1mol}$×100%=40%,实验组iii中CO的转化率αiii (CO)=$\frac{0.4mol}{1mol}$×100%=40%,所以αii (H2O)=αiii (CO).
故答案为:0.6;=.
(2)①负极CO发生氧化反应与O2-结合生成CO32-,负极电极反应式为:CO+2O2--2e-=CO32-;
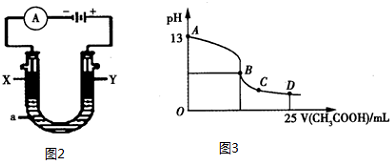
故答案为:CO+2O2--2e-=CO32-.
②电解池中阳极反应:2Cl--2e-=Cl2↑,阴极反应:2H2O+2e-=H2↑+2OH-,因此总电解方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑知,生成0.2mol氢氧根离子转移电子的物质的量=$\frac{0.2mol}{2}$×2=0.2mol,燃料电池的负极反应方程式是CO+2O2--2e-=CO32-,消耗1molCO转移电子数=2mol,因此当转移0.2mol电子时消耗CO的物质的量为0.1mol,则CO的质量=0.1mol×28g/mol=2.8g;
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;2.8g.
点评 本题难度较大,综合性强,综合了化学反应速率、平衡,以及原电池电解池等知识,非常好的一道题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 实验步骤 | 实验现象 |
| ①a和b相混合 | 气体变为红棕色 |
| ②c和d相混合 | 产生白烟 |
| ③c、e分别通入少量溴水中 | 都变成无色透明的溶液 |
| ④b、e分别通入氢硫酸中 | 都产生淡黄色的浑浊 |
| A. | O2、NO、HCl、NH3、CO2 | B. | O2、NO、NH3、HCl、SO2 | ||
| C. | NO、O2、NH3、HCl、SO2 | D. | HBr、Cl2、NH3、H2S、C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属与盐溶液的反应都是置换反应 | |
| B. | 阴离子都只有还原性 | |
| C. | 离子化合物中肯定存在离子键,可能不存在共价键 | |
| D. | 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3的摩尔质量为106 g | |
| B. | 金刚石与石墨互为同位素 | |
| C. | 常温下,4.6gNa中含有的质子数为2.2NA | |
| D. | 标准状况下,11.2LCO2完全参与反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 甲方案中的反应涉及置换、分解、复分解三种反应类型 | |
| C. | 乙方案中加过量铁粉只能还原其中的二种阳离子 | |
| D. | 丙方案不会产生环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)$?_{500℃}^{V_{2}O_{5}}$2SO3(g)△H=-196.6kJ/mol,若2molSO2完全反应则放出热量等于196.6kJ | |
| B. | “冰,水为之,而寒于水”说明相同质量的水和冰比较,冰的能量高 | |
| C. | 已知C(石墨)=C(金刚石)△H=+1.9kJ/mol,则从能量角度看金刚石比石墨稳定 | |
| D. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下,甲酸的导电性比强酸溶液的导电性弱 | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
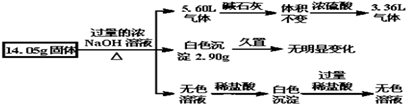
| A. | 一定含有Al,其物质的量为$\frac{5}{3}$mol | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有(NH4)2SO4和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com