高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe
2O
3(s)+3CO(g)?2Fe(s)+3CO
2(g)△H=a kJ?mol
-1.
(1)已知①Fe
2O
3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H
1=+489.0kJ?mol
-1;
②C(s,石墨)+CO
2(g)═2CO(g)△H
2=+172.5kJ?mol
-1.则a=
.
(2)冶炼铁反应的平衡常数表达式K=
,温度升高后,K值
(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为
.
②下列说法正确的是
(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe
2O
3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
(4)工业上利用CO与 H
2的混合气体在催化剂作用下合成甲醇,甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co
2+氧化成Co
3+,然后以Co
3+做氧化剂把水中的甲醇氧化成CO
2而净化.实验室用如图装置模拟上述过程:
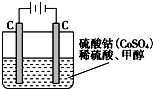
①写出阳极电极反应式
;
②写出除去甲醇的离子方程式
.
(5)某工业废液中含有Ba
2+、Sr
2+,为了回收Sr
2+.现向该废液中加入适量SO
42-并调节该溶液的PH至8-10,充分反应后过滤.若滤液中Ba
2+ 浓度为1×10
-5mol?L
-1,依表数据推算出滤液中Sr
2+物质的量浓度不大于
mol?L
-1.
| SrSO4 | BaSO4 | Sr(OH)2 |
| KSP | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 |




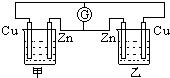 在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )
在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )
 ),该反应属于
),该反应属于