
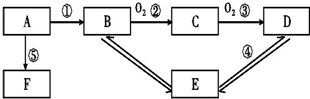
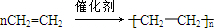 ;
;分析 A是一种平面形分子且能使溴水褪色,可做植物果实的催熟剂,则A为CH2=CH2,E是一种具有水果香味的有机物,E应为CH3COOCH2CH3,根据各物质转化关系可知,A与水发生加成反应生成B为CH3CH2OH,B氧化生成C为CH3CHO,CH3CHO进一步氧化可得D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOCH2CH3,F是一种可制成多种包装材料,高聚物F应为 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.
解答 解:A是一种平面形分子且能使溴水褪色,可做植物果实的催熟剂,则A为CH2=CH2,E是一种具有水果香味的有机物,E应为CH3COOCH2CH3,根据各物质转化关系可知,A与水发生加成反应生成B为CH3CH2OH,B氧化生成C为CH3CHO,CH3CHO进一步氧化可得D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOCH2CH3,F是一种可制成多种包装材料,高聚物F应为 ,
,
(1)根据上面的分析可知,A为CH2=CH2,C为CH3CHO,E为CH3COOCH2CH3,
故答案为:CH2=CH2;CH3CHO;CH3COOCH2CH3;
(2)反应④的化学方程式为:CH3COOC2H5+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3CH2OH+CH3COOH;反应⑤的化学方程式为: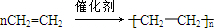 ,
,
故答案为:CH3COOC2H5+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3CH2OH+CH3COOH;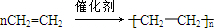 ;
;
(3)根据上面的分析可知,上述①~⑤的转化过程中,属于加成反应的是①⑤,故答案为:①⑤.
点评 本题考查有机物的推断,涉及烯、醇、醛、羧酸等的性质与转化等,根据A的性质利用顺推法进行推断,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 现有乙烯.丙烯.丁烯的混合气体共14g,其原子数为3NA | |
| C. | 1mol甲基(-CH3)所含的电子总数为7NA | |
| D. | 28g乙烯所含共用电子对数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
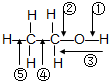
| A. | 和金属钠作用时,键①断裂 | |
| B. | 乙醇燃烧时所有键断裂 | |
| C. | 和乙酸、浓硫酸共热制乙酸乙酯时,键②断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体中只含离子键 | |
| B. | X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为H3XO4 | |
| C. | HCl的形成过程用电子式表示为 | |
| D. | 铝与稀盐酸的反应既是氧化还原反应,又是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 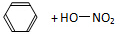 $\underset{\stackrel{浓{H}_{2}S{O}_{4}}{→}}{50~60℃}$ $\underset{\stackrel{浓{H}_{2}S{O}_{4}}{→}}{50~60℃}$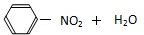 | |
| B. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3-CH2Cl | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{?}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯:与适量的氢气混合加热,把乙烯转化为乙烷 | |
| B. | 除去苯中的少量己烯:加入浓溴水振荡、静置后分液,除去己烯 | |
| C. | 验证丙烷中含有丙烯:通入溴水,溴水褪色 | |
| D. | 除去溴苯中的少量苯:加入水,振荡、静置分层后,取出上层即可分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
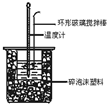 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )| A. | 改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用 50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
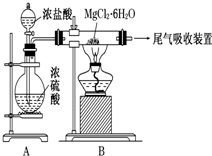
| A. | 尾气吸收可以用浓硫酸作为吸收剂进行吸收 | |
| B. | 装置A中圆底烧瓶中可以换成固体MnO2 | |
| C. | 如果直接加热MgCl2•6H2O不能得到无水氯化镁,将可能得到MgO | |
| D. | 金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com