
���бȽ��У���ȷ���ǣ� ��
A��ͬ�¶�ͬ���ʵ���Ũ��ʱ��HF��HCN���룬NaF��Һ��pH��NaCN��Һ��
B��0��2 mol ��L-1NH4Cl��0��1 mol��L-1 NaOH��Һ�������Ϻ�
c��NH4+��>c��Cl����>c��Na+��>c��OH-��>c��H+��
C��ͬŨ�ȵ�������Һ�У���NH4Al��SO4��2����NH4Cl����CH3COONH4����NH3��H2O��
c��NH4+���ɴ�С��˳����:��>��>��>��
D�����ʵ���Ũ����ȵ�H2S��NaHS�����Һ�У�
c��Na+��+c��H+��=c��S2-��+c��HS-��+c��OH-��
 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�������ʡ������12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������㶨���ܱ������У�һ������SO2��1.25mol O2�ڴ��������¼��ȵ�600�淢����Ӧ��2SO2(g)+O2(g)  2SO3(g) ��H��0������������ʵ�������0.45molʱ��Ӧ�ﵽƽ�⣬����ͬ���¶��²������ѹǿΪ��Ӧǰ��80%�������й�������ȷ����
2SO3(g) ��H��0������������ʵ�������0.45molʱ��Ӧ�ﵽƽ�⣬����ͬ���¶��²������ѹǿΪ��Ӧǰ��80%�������й�������ȷ����
A�����¶��µ�ƽ�ⳣ��Ϊ101.25 L/moL
B���ﵽƽ��ʱ��SO2��ת������90%
C�������¶ȣ�����Ӧ���ʼ�С�̶ȱ��淴Ӧ���ʼ�С�̶ȴ�
D����ƽ��������ͨ�����BaCl2��Һ�У��õ�����������Ϊ231.4g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʦ���С��ٴ�һ�и����ϵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
NA���������ӵ�������ֵ������˵����ȷ����
A��ij�¶��´�ˮ��pH��6�����¶���10 L pH��11��NaOH��Һ�к�OH������ĿΪNA
B����Mg��AlΪ�缫��NaOH��ҺΪ�������Һ��ԭ����У�����������NA�����ӣ��������ų�H2�����Ϊ11.2 L
C���ڷ�ӦZn��2HNO3��NH4NO3===N2����3H2O��Zn(NO3)2��ÿ�ܽ�1 mol Zn��ת�Ƶĵ�����������2NA
D��5.4 g Al�ֱ��뺬����0.2 mol��NaOH��Һ�����ᷴӦ������H2��������Ϊ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�������һ�и�һ��ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A�����ڿ�������ʴ���������Dz����ý���
B����ȼ��þ������ʢCO2�ļ���ƿ�У�Ѹ��Ϩ��
C�����ڸ������ܻ�ԭ�̡��������Ƚ���������
D��þ�������ã���������NaOH��Һ��Ӧ�ų�H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������������ȷ����
��Na2O��Na2O2���ܺ�ˮ��Ӧ���ɼ���Ƕ��Ǽ��������� ��Na2CO3��NaHCO3��Һ���ܸ�CaCl2��Һ��Ӧ�õ���ɫ���� �����ڳ����²����ױ����� ��Na2O2��������������Na2O���� �ݳ�ȥNa2CO3�����л��е�NaHCO3���������������������ٷ����仯 ���ò�����պȡ�����������ʵ�Ũ��Һ����ɫ��Ӧʵ��
A���ڢۢܢ� B���ܢ� C���ڢܢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶���ѧ��12���¿���ѧ�Ծ�����ʦ�棩 ���ͣ�ѡ����
�����£���������������ʵ���Ũ�ȵ�NH4HCO3��NaCl��Һ��ϣ���������NaHCO3���壬���ˣ�������ҺpH<7�����й�����Һ�е�����Ũ�ȹ�ϵ����ȷ����
A. 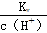 <1.0��10��7 mol/L
<1.0��10��7 mol/L
B��c(Na��)��c(HCO3-)��c(CO32-)��c(H2CO3)
C��c(H��)��c(NH4+)��c(OH��)��c(HCO3-)��2c(CO32-)
D��c(Cl��)>c(NH4+)>c(HCO3-)>c(CO32-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��д��ȷ����
A��ƫ��������Һ��ͨ�����CO2��2AlO2-+ CO2��3H2O = 2Al(OH)3����CO32-
B����������������������Һ��Al2O3��2OH- = 2AlO2-��H2O
C��ʯ��ˮ�м�������С�մ�Ca2+ + 2OH- + 2HCO3 - = CaCO3��+ CO32- + 2H2O
- = CaCO3��+ CO32- + 2H2O
D������ͭ��Һ������������Һ��ϣ�Cu2+ + 2OH- = Cu(OH)2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ͼ��ʾ��װ�ý�������ʵ�飬Ԥ��������ʵ���������
ѡ�� | ���е����� | ���е����� | ���е����� | Ԥ����е����� |
|
A | Ũ��ˮ | NaOH | AlCl3��Һ | �Ȳ�����ɫ������������ܽ� | |
B | Ũ���� | MnO2 | KI��Һ | ��Һ����ɫ | |
C | Ũ���� | Na2SO4 | Ba(NO3)2��Һ | �������� | |
D | Ũ���� | Cu | ����̪��NaOH��Һ | ��Һ��ɫ��ȥ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ��һ����ĩģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A���������ڿ����бȽ���ʴ���������Dz����ý���
B������ˮ�����ڸ����µķ�Ӧ����ΪFe2O3��H2
C��Na2CO3�����к��е�����NaHCO3�����ü��ȷ���ȥ
D�����ڲ�ͬ�������������ķ�Ӧ������ֻ�õ�Na2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com