
����Ŀ��̫���ܵ�ذ���ϳ��������⣬����ͭ�������������Ȼ�ѧ���ʡ�
��1����̬ͭԭ����________���˶�״̬��ͬ�ĵ��ӣ��������ռ������ܲ�ķ�����__________��ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ____________________��
��2�����������������Ԫ���γ���̬�⻯��������γɵ��������⻯��ķ��ӹ��ͷֱ�Ϊ______________��_______________��
������Si��H���й��õ��Ӷ�ƫ����Ԫ�أ�����������Ӧʱ�����������������������ĵ縺����Դ�СΪ Se___Si���>����<������
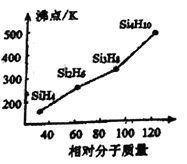
�����ǰѹ�����Ԫ���γɵ�һ�����й��顣�������ɡ��ṹ����Ӧ���������ƣ�����ķе�����Է��������Ĺ�ϵ��ͼ��ʾ���������ֱ仯��ԭ����________________________________________��
����������Ԫ�ش���ͬһ�������Ԫ�ؾ���ȱ�����ԣ��۵��������ڼ۲����������仯���������й¶Ե��ӵķ��ӻ���������������BF3����NH3��Ӧ����BF3��NH3��BF3��NH3��Bԭ�ӵ��ӻ��������Ϊ________________��B��N֮���γ�_________����
��4���黯��Ϊ�������뵼�壬����Ϊ��������ĵ����������������١�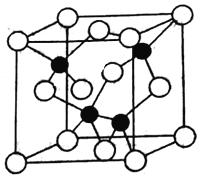
��֪�黯�صľ����ṹ��ͼ��ʾ�����黯�صĻ�ѧʽΪ____________��AS��Ga֮��Ļ�ѧ��Ϊ________��_________���黯���ܶ�Ϊ��g��cm-3�� Ga��As��Ħ�������ֱ�ΪMGa g��mol-1��MAs g��mol-1��ԭ�Ӱ뾶�ֱ�ΪrGa pm��rAspm�������ӵ�����ֵΪNA����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ______________���ú��Цѡ�NA�ȷ��ŵ�ʽ�ӱ�ʾ��
���𰸡� 29 N ���� V �� �������� > ��Է�������(M)Խ�������»���Խ�е�Խ�� sp3 ��λ�� GaAs ���ۼ� ��λ�� 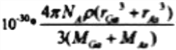 ��100%
��100%
����������1��CuԪ�غ˵����Ϊ29�����Ժ�������Ų�ʽΪ1s22s22p63s23p63d104s1����̬ͭԭ����29���˶�״̬��ͬ�ĵ��ӣ��������ռ������ܲ�ķ����� N��ռ��4s�ܲ���ӵĵ���������ͼ��״Ϊ���Σ���ȷ�𰸣�29�� N �� ���Ρ�
��2�����������������Ԫ���γ���̬�⻯��ֱ�ΪH2Se��SiH4������ԭ�����ӻ������=����ԭ�ӵŵ��Ӷ���+����ԭ�ӵ���������=2+1/2����6-2��=4������sp3�ӻ�����Ϊ��2�Թµ��Ӷԣ����Է��ӹ���ΪV��������ԭ�ӹ��ӻ������=����ԭ�ӵŵ��Ӷ���+����ԭ�ӵ���������=4+1/2����4-4��=4������sp3�ӻ�����Ϊû�йµ��Ӷԣ����Է��ӹ���Ϊ������������ȷ����V �Σ� �������塣
������Si��H���й��õ��Ӷ�ƫ����ԭ�ӣ�˵����������������������Ӧʱ��������������,���Ը��������������ĵ縺����Դ�СΪSe>Si����ȷ����>��
�۹���![]() ���Ƿ��Ӿ���,���Ӿ���ķе�ߵ�ȡ���ڷ��Ӽ�������,�����Ӽ�����������Է��������Ĵ�С�й�,�������Է�������Խ��,���Ӽ䷶�»���Խǿ����ȷ�𰸣���Է�������(M)Խ���»���Խ�е�Խ�ߡ�
���Ƿ��Ӿ���,���Ӿ���ķе�ߵ�ȡ���ڷ��Ӽ�������,�����Ӽ�����������Է��������Ĵ�С�й�,�������Է�������Խ��,���Ӽ䷶�»���Խǿ����ȷ�𰸣���Է�������(M)Խ���»���Խ�е�Խ�ߡ�
�� BF3��NH3��Bԭ�Ӻ���3��![]() ����1����λ��,������۲��������4,Bԭ�Ӳ�ȡsp3 �ӻ�,�û�������,Bԭ���ṩ�չ����Nԭ���ṩ�µ��Ӷ�,����B��Nԭ��֮���γ���λ������ȷ����sp3 �� ��λ����
����1����λ��,������۲��������4,Bԭ�Ӳ�ȡsp3 �ӻ�,�û�������,Bԭ���ṩ�չ����Nԭ���ṩ�µ��Ӷ�,����B��Nԭ��֮���γ���λ������ȷ����sp3 �� ��λ����
��4�����ݾ����ṹ��֪���ԭ�Ӹ���Ϊ8��1/8+6��1/2=4, ��ԭ�Ӹ���Ϊ4,������1:1������黯�صĻ�ѧʽΪGaAs�������ڹ��ۻ����AS��Ga֮��Ļ�ѧ��Ϊ���ۼ�����λ�����黯���ܶ�Ϊ�� gcm-3�����ݾ�̯�����㣬As��8��1/8+6��1/2=4, Ga��4��1=4�����Ըþ�������4��GaAs�����侧����ԭ����ռ�����V1=(4/3��r3As��4+4/3��r3Ga��4)��10-30�����������V2=m/��= ����GaAs������ԭ�ӵ����ռ��������İٷ���ΪV1/V2��100%����V1��V2�������ðٷ���=
����GaAs������ԭ�ӵ����ռ��������İٷ���ΪV1/V2��100%����V1��V2�������ðٷ���=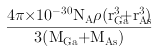 ��100%����ȷ�𰸣�GaAs �� ���ۼ��� ��λ����
��100%����ȷ�𰸣�GaAs �� ���ۼ��� ��λ���� 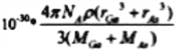 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��״���µ��ܶ�Ϊ1.16 g��L��1����AΪԭ����һ�������¿ɻ���л���B��C��D��E��F�����ת����ϵ��ͼ��FΪ��Ũ����ζ����������ˮ����״Һ�塣

��ش�
��1��A�Ľṹ��ʽ________________��
��2��D��E��F�ķ�Ӧ������__________��
��3���л���Aת��ΪB�Ļ�ѧ����ʽ��___________________________________��
��4������˵����ȷ����_________��
A���л���E������Ʒ�Ӧ��ˮ������Ʒ�ӦҪ���ҡ�
B���л���E������Ʒ�Ӧ�IJ��������ˮ��Ӧ��������E��
C���л���D��E��F���ñ���Na2CO3��Һ����
D������ת����ϵͼ�й��漰3�μӳɷ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������������ȡ��������(��Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3����������������)��ȡ��ˮ����������(FeSO4��7H2O)��������������̣�

����˵������ȷ���ǣ� ��
A. �ܽ�����ѡ���������ᣬ�Լ�Xѡ������
B. ����1��һ������SiO2������pH��Ϊ��ʹAl3+ת��ΪAl(OH)3���������2
C. ����Һ2�õ�FeSO4��7H2O��Ʒ�Ĺ����У������������ֹ�������ͷֽ�
D. ���ı䷽��������Һ1��ֱ�Ӽ�NaOH���������õ��ij����������ܽ⣬����Һ���ᾧ����Ҳ�ɵõ�FeSO4��7H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CO��H2�ڴ����������ºϳɼ״�����Ӧ���£�CO(g)+2H2(g)=CH3OH(g)����2L�ܱ������г������ʵ���֮��Ϊ1��2��CO��H2���ڴ��������³�ַ�Ӧ�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯����ͼ��ʾ������˵����ȷ����
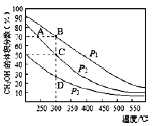
A���÷�Ӧ�ġ�H<O����p1��p2��p3
B����C��ʱ��H2ת����Ϊ75%
C����Ӧ���ʣ�v��(״̬A��>v��(״̬B��
D���ں��º�ѹ�����£�����ܱ��������ٳ���1molCH3OH��
��ƽ��ʱCH3OH�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̽��������ˮ�ɷּ����ʵ�ʵ���У��������з������������ܵó���Ӧ���۵���
���� | ���� | ���� | |
A | �۲���ˮ��ɫ | ��ˮ�ʻ���ɫ | ��ˮ�к�Cl2 |
B | ��NaHCO3��Һ�м���������ˮ | ����ɫ������� | ��ˮ�к�HClO |
C | ���ɫֽ���ϵμ���ˮ | ��ɫֽ����ɫ | ��ˮ����Ư���� |
D | ��FeCl2��Һ�еμ���ˮ | ��Һ����ػ�ɫ | ��ˮ���������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���K+��Na+��Fe3+��Fe2+��SO42-��CO32-��I-��Cl-�е�һ�ֻ���֣�������ͼ��ʾ��ʵ�飬����˵����ȷ���� ( )
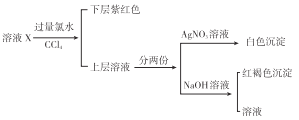
A. ��ҺX����Fe3+��SO42-
B. ��ҺX����Fe2+��I-������SO42-��Cl-
C. ��ҺX����I-��Cl-����CO32-
D. ��ҺX����I-��Fe2+��Fe3+����������������һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����鰱����ѡ�ã���
A. ʪ�����ɫʯ����ֽ B. ����ĺ�ɫʯ����ֽ
C. �������ɫʯ����ֽ D. ʪ��ĺ�ɫʯ����ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����(�� ��)
A. ��H2O2�μӵ�����KMnO4��Һ�У�2MnO4���� H2O2 �� 6H�� === 2Mn2�� �� 3O2���� 4H2O
B. ��NH4HSO4��Һ��������������ʵ�����NaOH��Һ��NH4+�� OH�� === NH3��H2O
C. �ö��Ե缫����Ȼ�����Һ��2H�� �� 2Cl�� === H2�� �� Cl2��
D. �����Ը��������Һ�ζ����2MnO4���� 5H2C2O4 �� 6H�� === 2Mn2�� �� 10CO2�� �� 8H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com