
某河道两旁有甲、乙两个化工厂。它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
(1)经测定甲厂的废水明显呈酸性,故乙厂废水中所含的三种离子应该是 。
(2)如果要回收废水中的金属银,可以在废水中加入过量的一种常见金属,反应后的溶液中只含一种金属阳离子,过滤所得固体的成分是 ,要进一步分离出银,方法是 。
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出生成红褐色沉淀的离子方程式是: 。
(1) OH- Na+ Cl-
(2)Fe、Ag;向固体中加入足量稀硫酸,充分反应后过滤,洗涤即得到银。 (3) Fe3+ +3OH-=Fe(OH)3↓
解析试题分析:(1)甲厂的废水明显呈酸性,则甲厂废水中不可能含有大量的OH-,即OH-一定在乙厂废水中。又因为OH-与Ag+、Fe3+均不能大量共存,所以Ag+、Fe3+只能在甲厂废水中。而Ag+不能与氯离子大量共存,所以氯离子在甲厂。根据溶液显电中性可知,甲厂废水中一定还含有钠离子,所以甲、乙厂废水中所含的三种离子应该分别是Ag+、Fe3+、NO3-以及OH-、Na+、Cl-。
(2)如果要回收废水中的金属银,可以在废水中加入过量的一种常见金属,反应后的溶液中只含一种金属阳离子,这说明该金属一定是铁。铁是活泼的金属与银离子发生置换反应生成亚铁离子和单质银,同时过量的铁 也与铁离子反应生成亚铁离子,所以过滤所得固体的成分是Fe、Ag;银的金属性很弱,所以要进一步分离出银,可向固体中加入足量稀硫酸,充分反应后过滤,洗涤即得到银。
(3)将甲厂和乙厂的废水按适当的比例混合,可生成AgCl、Fe(OH)3↓沉淀,其中氢氧化铁是红褐色沉淀,所以生成氢氧化铁的离子方程式为Fe3+ +3OH-=Fe(OH)3↓。
考点:考查离子共存的有关判断以及物质的分离与提纯


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
近年来,太湖蓝藻爆发,造成无锡市水质的严重恶化。这些事件再次敲响了我国水危机的警钟。在太湖流域某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含有Fe3+、Ba2+、K+、OH-、Cl-、 、
、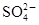 。为了进一步确认,取样进行实验检测:
。为了进一步确认,取样进行实验检测:
①取污水仔细观察,呈无色、透明、均一状态。
②向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
③用pH试纸测定污水的pH,试纸显深蓝色。
(1)由此可知,该污水中肯定含有的离子是___________,肯定没有的离子是___________,可能含有的离子是___________。
(2)如何通过实验进一步确定溶液中可能存在的离子__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I、NaOH、FeCl3是中学化学实验室常用的试剂。
(1)在一定条件下能与NaOH溶液反应的固体单质有________和________(举两例)。
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是________。
| A.容量瓶中原有少量蒸馏水 |
| B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中; |
| C.定容时观察液面俯视 |
| D.溶解后未经冷却立即转移至容量瓶内 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一瓶澄清的溶液,其中可能含H+、NH4+、K+、Cu2+、Fe3+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性
②取部分溶液,加入数滴新制的氯水及少量的CCl4,振荡后CCl4层显紫色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有 ,肯定不存在的离子有 。
(2)不能确定是否存在的离子有_______。证明它(们)是否存在的实验方法是 。
(3)写出步骤②涉及的离子方程式,并用单线桥标出电子转移的方向和数目 。
(4)写出步骤④涉及的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有以下物质:①KCI晶体②食盐水③液态的醋酸④I2⑤BaSO4固体⑥蔗糖(C12H22O11 )⑦酒精(C2H5OH)⑧熔融的NaOH⑨K2O⑩SO2。请回答下列问题:
(1)以上物质中能导电的是_________________(用序号)。
(2)以上物质属于电解质的是_________________(用序号)。
(3)以上物质中属于非电解质的是_________________(用序号)。
(4)从②溶液中得到氯化钠固体,应选择下列装置中的______________(填代表装置图的字母,下同);分离④与⑦的混合液,应选择下列装置中的________________。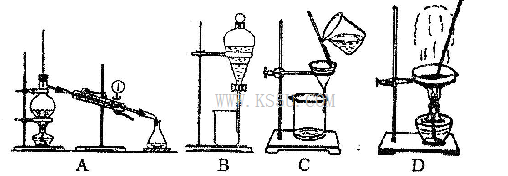
(5)请写出③和⑧中两种物质的溶液混合后发生反应的离子方程式:________________________________________________________________________.
(6)在标准状况下,__________L⑩与34. 2g⑥中含有相同的氧原子数。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有以下物质:①NaCl晶体, ②液态SO3, ③液态醋酸, ④汞,⑤BaSO4固体,⑥蔗糖(C12H22O11),⑦酒精(C2H5OH),⑧熔融KNO3
请回答下列问题(填序号):
(1)以上物质中能导电的是 ;
(2)以上物质中属于电解质的是 ;
(3))以上物质中属于非电解质的是 ;
(4)以上物质中属于弱电解质的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: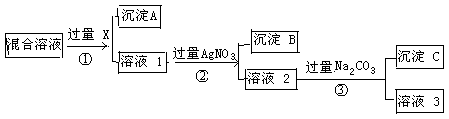
请回答下列问题:⑴写出实验流程中下列物质的化学式
试剂X : 沉淀A:
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质。
(4)请写出①②中反应的离子方程式①
②
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:SO32-、CO32-、SiO32-、I-、NO3-、SO42-。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。
(1)原溶液中是否有SiO32-? (填“有”或“没有”),判断理由是 。(用离子方程式表示)
(2)生成的气体中一定有 。它具有的性质是 (填字母序号)。
| A.无色无味 |
| B.无色有刺激性气味 |
| C.属于大气污染物 |
| D.难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几
种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积),回答下列问题: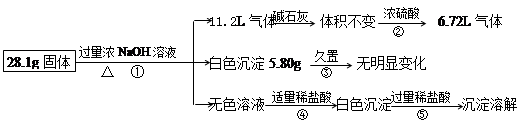
(1)混合物中是否存在FeCl2 ___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: 。
(4)请根据计算结果判断混合物中是否含有AlCl3_ _(填“是”或“否”),你的判断依据是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com