
盐酸是应用广泛的酸之一,它具有:①酸性 ②氧化性 ③还原性 ④挥发性。请回答下列问题:
(1)浓盐酸长时间露置在空气中,溶液的质量减轻表现了____________(填序号)。
(2)实验室用稀盐酸和锌粒反应制取氢气表现了____________(填序号),反应的离子方程式为- 。
(3)用盐酸除去铁表面的铁锈表现了____________(填序号),反应的离子方程式为_________________。
(4)实验室常用KMnO4和浓盐酸反应制取Cl2,反应的方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①被还原的元素是____________,还原剂是____________。
②氧化产物是____________,若生成5 mol Cl2,转移的电子总数为____________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
57.叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠___g。
58.钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
(2)计算并确定该钠-钾合金的化学式。
59.氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
60.常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
|
| 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省苏南四校高三12月月考试化学试卷(带解析) 题型:填空题
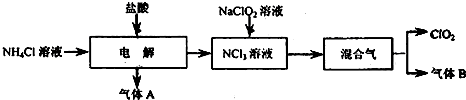
(14分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)实验室制取气体B的化学方程式为 。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30 min”,立即进行步骤3,则测定的结果可能
(选填“偏大”、“偏小”、“无影响”);
②上述步骤3中滴定终点的现象是 。
③根据上述步骤可计算出原ClO2溶液的浓度为 g / L(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014届四川省资阳市高三第一次诊断性考试理综化学试卷(解析版) 题型:填空题
高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和医疗上有非常广泛的应用。以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:


(1)操作Ⅱ的名称是_______,实验室进行该操作须用到的玻璃仪器有 ;
(2)反应②的产物中,氧化产物与还原产物的物质的 量之比是______;
(3)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
a.稀盐酸 b.稀硫酸 c.稀醋酸
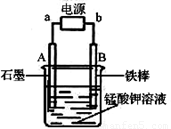
(4)电解锰酸钾溶液也可以制备高锰酸钾,其阴极反应式为:2H2O + 2e- = 2OH- + H2↑,如图,b为电源的_______极,电解池的阳极反应式是_______;若电解过程中收集到2.24 L H2(标准状况),则得到高锰酸钾______g。(提示:阴离子放电顺序MnO42->OH-)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市河西区高三总复习质量检测(二)理综化学试卷(解析版) 题型:实验题
铁及其化合物在生产和生活中有着广泛的应用。某实验小组设计了如下实验探究
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00
mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO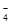 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0200
mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO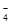 还原成Mn2+。
还原成Mn2+。
重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com