
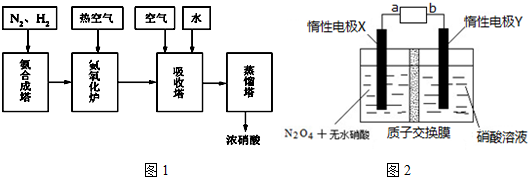
分析 (1)根据向装置中再充入O2、降低温度平衡正向移动,氮氧化物的转化率增大,加入反应的催化剂只改变反应速率,平衡不移动;
(2)由已知热化学方程式根据盖斯定律构造目标热化学方程式;
(3)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成.阴极反应式为2H++2e-=H2,所以工作一段时间后,硝酸水溶液的氢离子基本不变即pH不变;
(4)二氧化氮具有氧化性,亚硫酸钠具有还原性,根据氧化还原反应的规律知识来回答判断.
解答 解:(1)向装置中再充入O2、降低温度平衡正向移动,氮氧化物的转化率增大,加入反应的催化剂只改变反应速率,平衡不移动,
故答案为:a;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由盖斯定律可知,①-②÷2+③×$\frac{3}{2}$得:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
(3)N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+.阴极反应式为2H++2e-=H2,所以工作一段时间后,硝酸水溶液的氢离子基本不变即pH不变;
故答案为:负,N2O4+2HNO3-2e-=2N2O5+2H+,不变;
(4)二氧化氮具有氧化性,亚硫酸钠具有还原性,二者之间会发生氧化还原反应:2NO2+4SO32-=N2+4SO42-,再结合化学反应2NO+ClO2+H2O=NO2+HNO3+HCl知道,
N2~2NO2~2ClO2,所以若生成标准状况下22.4LN2,则n( N2 )=$\frac{V}{{V}_{m}}$=$\frac{22.4L}{22.4L/mol}$=1mol,则消耗2molClO2,质量m=nM=2mol×67.5g/mol=135g,
故答案为:2NO2+4SO32-=N2+4SO42-,135g;
点评 本题综合考查化学反应原理的基础知识,涉及反应热计算、化学平衡影响因素、氧化还原反应及计算、电解原理等,题目难度中等,注意相关知识的积累


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的纯碱溶液中含有0.1NA个Na+ | |
| B. | 常温常压下,23g NO2中含有NA个氧原子 | |
| C. | 常温常压下,22.4L CCl4含有个NACCl4分子 | |
| D. | 1molFe与足量的盐酸反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
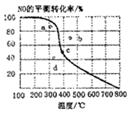 如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液 | |
| C. | 盛放准确量取待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定操作应重复2至3次,并求出滴定用去的溶液体积的平均值,计算出待测液的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com