
【题目】KI用于分析试剂、感光材料制药和食品添加剂等。
制备原理如下:反应① 3I2+6 KOH =a KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O

按照下列实验过程,请回答有关问题。
(1)启普发生器中发生的化学方程式为______________________,用该装置还可以制备___________(填一种气体化学式)。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到______________________(填现象),停止滴人KOH溶液;然后______________________(填操作),待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液,并对KI混合液水浴加热,其目的是______________________。
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和___________,其中加入碳酸钡的作用是______________________。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为___________g。
【答案】ZnS + H2SO4 ═ H2S↑+ Zn SO4 H2 (CO2) 棕黄色溶液变为无色 打开启普发生器活塞,通入气体 使溶液酸化并加热,有利于H2S溢出,从而除去H2S 硫 除去多余的硫酸 33.2g
【解析】
(1)启普发生器中发生的的反应用于制备H2S,属于固体与液体不加热的反应制气装置,用该装置还可以制备H2 (CO2) 等。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,发生① 3I2+6 KOH =a KIO3+5KI+3H2O,待观察到棕黄色溶液变为无色,停止滴人KOH溶液;然后通入H2S,完成反应② 3H2S+KIO3=3S↓+KI+3H2O,打开启普发生器活塞,通入气体,待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液使溶液酸化,并对KI混合液水浴加热,有利于H2S溢出,从而除去H2S。
(4)沉淀中有反应②生成的硫,过量的硫酸用碳酸钡除去。
(5)如果得到3.2g硫单质,则理论上制得的KI,根据方程式得关系式3S~6KI计算。
(1)启普发生器中发生的的反应用于制备H2S, 化学方程式为:ZnS + H2SO4 ═ H2S↑+ Zn SO4 ,属于固体与液体不加热的反应制气装置,用该装置还可以制备H2 (CO2) 等。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,发生① 3I2+6 KOH =a KIO3+5KI+3H2O,待观察到棕黄色溶液变为无色,停止滴人KOH溶液;然后通入H2S,完成反应② 3H2S+KIO3=3S↓+KI+3H2O,打开启普发生器活塞,通入气体,待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液使溶液酸化,并对KI混合液水浴加热,目的:使溶液酸化并加热,有利于H2S溢出,从而除去H2S。
(4)沉淀中有反应②生成的硫,过量的硫酸用碳酸钡除去。
把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和硫,其中加入碳酸钡的作用是除去多余的硫酸 。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为:
反应① 3I2+6 KOH =1KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O得关系式
S~2KI
32 2×166
3.2g m
m= 33.2g


科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是

A. 放电时,纸张中的纤维素作为锂电池的负极
B. 充电时,若阳极放出1molO2,则有4mol e-回到电源正极
C. 开关K闭合给锂电池充电,X对应充电电极上的反应为Li++e-=Li
D. 放电时,Li+由正极经过有机电解质溶液移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。并且Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOC12=4LCl+S+SO2。
(1)组装该电池必须在无水、无氧的条件下进行,原因是______________________。
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为______________________。用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量之比为___________。
(3)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
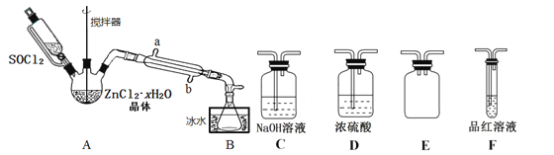
①用原理解释SOCl2在该实验中的作用:_________________________________。
②装置的连接顺序为A→B→______________________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)。
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克
c.干燥 d.称取蒸干后的固体m克溶于水
e.过滤 f.洗涤
(4)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl2的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为_________________________________。
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加人足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加适量的醋酸钠晶体后,两溶液的c(H+)均减小
B. 使温度都升高20℃后,两溶液的c(H+)均不变
C. 加水稀释2倍后,两溶液的c(H+)均增大
D. 加足量的锌充分反应后,两溶液中产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物M的结构简式如下图所示,有关该化合物的叙述正确的是( )

A. 属于芳香烃B. 分子式为:C11H14O2
C. 最多有11个碳原子共面D. 能发生化学反应的类型只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 等物质的量的NaN3和Na2O2中所含阴离子数均为NA
B. 14.2g C10H22中含有共价键总数为3.1NA
C. 标准状况下,将3.36L Cl2通入1L 0.2mol/L FeBr2溶液中,被氧化的Br-数目为0.3NA
D. 标准状况下,11 g由3H和16O组成的超重水中,中子数和电子数之和为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)了解用药常识,有利于自我保健。现有下列药物:
A.阿司匹林(乙酰水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是____________。(填字母)
②治疗胃酸过多,但患有严重的胃溃疡,应该选择___________。(填字母)
③一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是____________。(填字母)
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是___________。(填字母)
(2)防治环境污染,改善生态环境已成为全球的共识。
①今年入冬以来,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是_______(填字母)。
A.SO2 B.NO2 C.PM2.5
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________ (填字母)标志的垃圾筒内。

③工业废水需处理达标后才能排放。下列废水处理的方法合理的是____________。
A.用中和法除去废水中的酸
B.用混凝剂除去废水中的重金属离子
C.用氯气除去废水中的悬浮物
(3)全世界每年因钢铁锈蚀造成大量的损失。某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验。
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验内容 |
|
|
|
请回答:
①在一周的观察过程中,他发现实验序号为______的试管中铁钉锈蚀速度最慢。
②下列防止钢铁锈蚀的措施不合理的是__________(填字母)。
A.在自行车的钢圈表面镀镍
B.在地下钢铁管道上连接铜块
C.改变金属内部结构制成不锈钢
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:铁锅的腐蚀主要是由__________________腐蚀造成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=6HCl+N2。下列说法错误的是( )
A.若管道漏气,遇氨就会产生白烟
B.该反应属于复分解反应
C.该反应属于氧化还原反应
D.该反应中Cl2是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ·mol-1,②2NO(g)+O2(g)===2NO2(g) ΔH=-113.0 kJ·mol-1。下列热化学方程式正确的是
A. NO2(g)+SO2(g) ![]() SO3(s)+NO(g) ΔH=-41.8 kJ·mol-1
SO3(s)+NO(g) ΔH=-41.8 kJ·mol-1
B. SO3(g)+NO(g) ![]() NO2(g)+SO2(g) ΔH=+41.8 kJ·mol-1
NO2(g)+SO2(g) ΔH=+41.8 kJ·mol-1
C. NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH=-77.4 kJ·mol-1
SO3(g)+NO(g) ΔH=-77.4 kJ·mol-1
D. NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH=-183.6 kJ·mol-1
SO3(g)+NO(g) ΔH=-183.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com