
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 探究不同温度对反应速率的影响 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影 响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
分析 (1)依据盖斯定律计算[①+②+③×4]×$\frac{1}{2}$得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式;
(2)Ⅰ.①高锰酸钾具有强氧化性,能把草酸氧化成二氧化碳,自身被还原成二价锰离子;
②根据滴定管的使用规则判断;
③配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,溶液的体积偏小,配制的溶液的浓度偏大,滴定时消耗的高锰酸钾溶液的体积偏小;
Ⅱ.④实验1、2只有温度不同,其他用量完全相同;
⑤高锰酸钾的物质的量相同,浓度不同的草酸溶液,可以探究反应物浓度对该反应速率的影响;
⑥酸性条件下,高锰酸根离子能将氯离子氧化成氯气.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-l
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2 O(g)△H=-1160kJ•mol-l
③H2O(g)═H2O(l)△H=-44.0kJ•mol-l
依据盖斯定律计算[①+②+③×4]×$\frac{1}{2}$得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1)△H=-955 kJ•mol-1;
(2)Ⅰ.①高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,根据得失电子守恒,高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
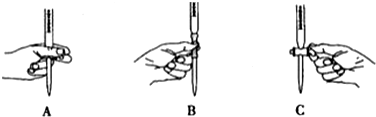
②根据滴定管的使用规则,滴定时,左手握住滴定管的活塞控制液滴的滴出,防止活塞被意外打开,即如图A所示操作,
故答案为:A;
③配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,溶液的体积偏小,配制的溶液的浓度偏大,滴定时消耗的高锰酸钾溶液的体积偏小,则消耗的高锰酸钾的物质的量偏小,由2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,测定的草酸的物质的量偏小,即测得的草酸溶液浓度偏低,
故答案为:偏低;
Ⅱ.④实验1、2反应物用量完全相同,只有温度不同,目的就在于探究温度不同对反应速率的影响,
故答案为;探究温度不同对反应速率的影响;
⑤因根据表格中的褪色时间长短来判断浓度大小与反应速率的关系,需满足高锰酸钾的物质的量相同,浓度不同的草酸溶液,
故答案为:其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间;
⑥酸性条件下,高锰酸根离子能将氯离子氧化成氯气,自身被还原成二价锰离子,反应方程式为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O,
故答案为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
点评 本题考查了盖斯定律的计算,温度、浓度对反应速率的影响、浓度随时间变化的曲线,题目难度中等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.12g | B. | 3.9g | C. | 0.78g | D. | 2.34g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
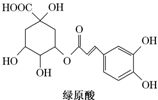 绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )| A. | 奎尼酸分子式为C7H12O6 | |
| B. | 绿原酸能发生取代、加成、消去和缩聚反应 | |
| C. | 1mol奎尼酸与NaOH溶液反应,最多消耗5mol NaOH | |
| D. | 咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向苯酚溶液中逐滴加入浓溴水,生成白色沉淀: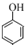 +3Br2→ +3Br2→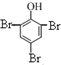 ↓+3HBr ↓+3HBr | |
| B. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ | |
| C. | 向水杨酸(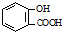 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: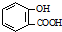 +2HCO3-→ +2HCO3-→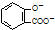 +2CO2↑+2H2O +2CO2↑+2H2O | |
| D. | 向Ba(OH)2中加入H2SO4至中性:Ba2++OH-+SO42-+H+→BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中气体密度的不随时间变化 | |
| B. | 容器中气体的平均相对分子质量不随时间变化 | |
| C. | 2VA(消耗)=VB(生成)时 | |
| D. | C和D的消耗速率相等时 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
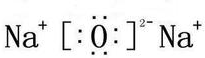 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com