
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
分析 (1)根据题中信息及化合价升降法配平反应的化学方程式,然后根据电子守恒计算出1mol草酸完全反应转移的电子数;将该化学方程式改成离子方程式即可;
(2)根据探究温度对反应速率影响时除了温度外其它条件必须相同判断;根据体积浓度对反应速率影响时除了浓度不同,其他条件必须完全相同分析;
(3)先根据醋酸和高锰酸钾的物质的量判断过量,然后根据不足量及反应速率表达式计算出反应速率.
解答 解:(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,改写成离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O;
H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2(4-3)价,所以每消耗1mol H2C2O4转移2mol电子,
故答案为:2;5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②,
故答案为:②和③; ①和②;
(3)草酸的物质的量为:0.10mol•L-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010mol•L-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:$\frac{0.010mol/L×0.004L}{0.002L+0.004L}$=$\frac{2}{3}$×0.010mol/L,
这段时间内平均反应速率v(KMnO4)=$\frac{\frac{2}{3}×0.010mol/L}{\frac{40s}{60s/min}}$=0.010mol•L-1•min-1,
故答案为:0.010或1.0×10-2.
点评 本题考查了探究温度、浓度对反应速率的影响,题目难度中等,注意掌握温度、浓度、压强等对反应速率的影响,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基(CH3-)所含的电子数为10NA | |
| B. | 46g由NO2和N2O4组成的混合气体中,含有的原子总数为3NA | |
| C. | 常温常压下,1mol分子式为C2H6O的有机物中,含有C-O键的数目为NA | |
| D. | 标准状次下产22.4L四氯化碳中含有C-Cl键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
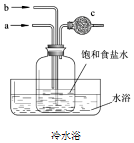
| A. | 先从b管通入NH3再从a管通入CO2 | B. | 先从a管通入CO2再从b管通入NH3 | ||
| C. | 广口瓶内有白色沉淀析出 | D. | c中试剂为碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2R是二元弱酸,其Ka1=1×10-2 | |
| B. | NaHR在溶液中水解程度小于电离程度 | |
| C. | pH<7.2的溶液中一定存在:c( Na+)>c( HR-)>c(R2-)>c(H+)>c(OH-) | |
| D. | 含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
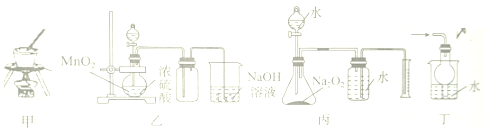
| A. | 利用甲装置甲从海水中提取NaCl晶体 | |
| B. | 利用装置乙制备并收集Cl2 | |
| C. | 利用装置丙测定变质Na2O2的纯度 | |
| D. | 利用装置丁吸收HCl尾气,防止液体倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
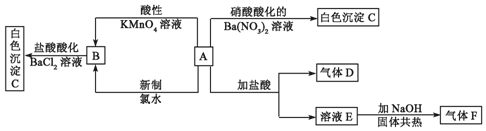
 ;F的结构式
;F的结构式 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
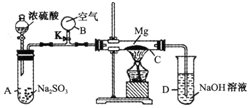 按如图装置进行如下实验,请用你所学知识完成下题:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发生耀眼白光,产生白烟,管壁上附有淡黄色物质.实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.
按如图装置进行如下实验,请用你所学知识完成下题:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发生耀眼白光,产生白烟,管壁上附有淡黄色物质.实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com