
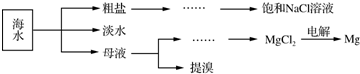
分析 海水淡化得到淡水,另外蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐;母液加氢氧化钠反应生成氢氧化镁沉淀,氢氧化镁和酸反应生成氯化镁,制得氯化镁,母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质得到高浓度的溴.
(1)惰性电极电解NaCl溶液,生成NaOH、氢气、氯气;粗盐中含有Ca2+、Mg2+及SO42-,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子;
(2)海水淡化海水就是将海水中的可溶性杂质除去的过程,可根据淡化原理进行分析;
(3)用电解法制Mg时,通常在MgCl2中加入CaCl2,可使氯化镁熔融温度降低,从而减少能耗;
(4)通入热空气和氯气,发生氧化还原反应生成溴,空气将溴吹出,通入二氧化硫,发生Br2+SO2+H2O═2HBr+H2SO4,富集后再通入氯气,生成溴.
解答 解:(1)惰性电极电解NaCl溶液,阳极上是氯离子失电子,2Cl--2e-=Cl2↑,阴极上是氢离子得电子,2H++2e-=H2↑,由两极上的电极反应可以得到总反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则试剂可依次加入NaOH、BaCl2、Na2CO3、HCl,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;BaCl2 Na2CO3;
(2)A.蒸馏法,是把水从水的混合物中分离出来,得到纯净的水,故A正确;
B.萃取法,对于微溶于水的有机物,可用萃取法,水中没有微溶于水的有机物,故B错误;
C.通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的,故C正确;
D.利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果,故D正确;
故答案为:ACD;
(3)离子浓度越大其熔融盐的导电性越强,在MgCl2中加入CaCl2,进行电解,增大离子浓度,从而增大熔融盐的导电性,使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗,
故答案为:使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗;
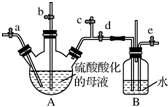
(4)A中海水用硫酸酸化,关闭a、c,打开b、d、e,由b向A中通入热空气和氯气,发生氧化还原反应生成溴,空气将溴吹出,同时由e向B中通入足量SO2,发生Br2+SO2+H2O═2HBr+H2SO4,富集后再关闭b、e,打开a,再由a向B中缓慢通入足量Cl2,生成溴,
故答案为:关闭a、c,打开b、d、e,由b向A中鼓入足量热空气,同时由e向B中通入足量SO2;关闭b、e,打开a,再由a向B中缓慢通入足量Cl2.
点评 本题考查了海水资源综合利用,涉及了离子的除杂、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性,本题难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能说明非金属性Cl>C:2HClO3+CaCO3=Ca(ClO3)2+CO2↑+H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ | |
| D. | 铅酸蓄电池充电时的负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | B. | Al3+的结构示意图: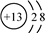 | ||
| C. | NaClO的电子式: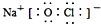 | D. | 硝基苯的结构简式: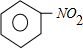 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
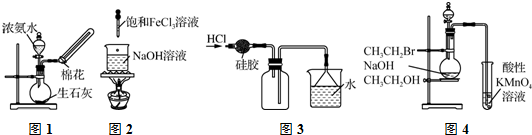
| A. | 利用图1所示装置制取少量NH3 | |
| B. | 利用图2所示装置制备Fe(OH)3胶体 | |
| C. | 利用图3所示装置收集HCl | |
| D. | 利用图4所示装置检验是否生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中氧化铝的含量 |
| D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com