
对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各混合物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘____________。
(2)除去食盐溶液中的水____________。
(3)淡化海水____________。
(4)除去KC1固体中含有的少量KC1O3____________。
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源:2017届江苏省高三上学期期中化学卷(解析版) 题型:实验题
钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
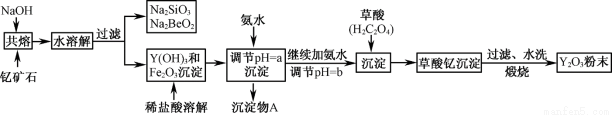
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | |
Fe3+ | 2.7 | 3.7 | |
Y3+ | 6.0 | 8.2 | |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和 两种试剂,再通过必要的操作即可实现。
A.NaOH溶液  B.氨水 C.CO2 D.HNO3
B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在 范围内;继续加氨水调节pH =b发生反应的离子方程式为 ;检验Fe3+是否沉淀完全的操作方法是 。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3.nH2O]煅烧的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市四校高一期中联考化学试卷(解析版) 题型:实验题
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示: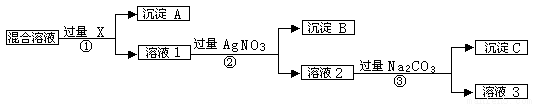 请回答下列问题:
请回答下列问题:
⑴写出实验流程中下列物质的化学式 试剂X__________,沉淀A___________,沉淀B__________。
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,如果要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市四校高一期中联考化学试卷(解析版) 题型:选择题
不能用有关胶体的观点解释的现象是 ( )
A. 在江河入海处易形成三角洲
B. AgNO3溶液中滴入同浓度NaCl溶液,生成白色沉淀
C. 卤水点豆腐
D. 同一钢笔同时使用不同牌号的墨水易发生堵塞
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高一上学期期中化学试卷(解析版) 题型:填空题
将25℃、101 kPa条件下的氯化氢(HCl)气体49.6 L,通入127 mL水中(已知水的密度为1.00 g.cm-3),得到密度为1.19 g.cm-3的盐酸。(已知:25℃、101 kPa条件下,气体摩尔体积为24.8 L.mol-1)
(1)此盐酸的溶质的质量分数为_____________。
(2)此盐酸的溶质的物质的量浓度为_____________mol/L。
(3)取出20.0 mL该溶液,配成浓度为1.00 mol.L-l的稀溶液,则稀释后溶液的体积是______mL。
(4)0.100 mol.L-1的稀盐酸500 mL中含有的氯离子的数目为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高一上学期期中化学试卷(解析版) 题型:选择题
等质量的①CH4、②H2、③HC1、④SO2四种气体,在标准状况下体积由大到小的顺序是
A.②>①>③>④ B.④>③>①>② C.③>②>④>① D.①>④>②>③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高一上学期期中化学试卷(解析版) 题型:选择题
下列基本反应类型中,一定是氧化还原反应的是( )
A.复分解反应 B.置换反应 C.分解反应 D.化合反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高二上学期期中化学试卷(解析版) 题型:选择题
下列两组热化学方程式中,有关△H的比较正确的是( )
①CH4(g)+O2(g)=CO2(g)+2H2O(g) △H1
CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H2
②NaOH(aq)+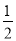 H2SO4(浓)=
H2SO4(浓)=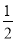 Na2SO4(aq)+H2O(1) △H3
Na2SO4(aq)+H2O(1) △H3
NaOH (aq)+CH3 COOH( aq)=CH3COONa( aq)+H2O(1) △H4
A.△Hl>△H2,△H3>△H4, B.△HI>△H2,△H3<△H4
C.△H1=△H2,△H3 =△H4 D.△Hl<△H2,△H3<△H4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上期中化学卷(解析版) 题型:填空题
氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为___________________。
(2)稼氮砷合金材料的太阳能电池效率达40%,Ga、N、As电负性由大至小的顺序是__________________
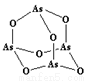
(3)As4O6的分子结构如右图所示,其中As原子的杂化方式为___________________,1 mol As4O6含有σ键的物质的量为_______________。
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示。则Y轴可表示的氢化物(RH3)性质可能是 。
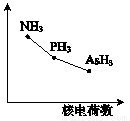
A.稳定性 | B.沸点 | C.R-H键能 | D.分子间作用力 |
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com