
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下 ( )

该同学得出的结论正确的是
A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素
B.根据现象2可推出该固体粉末中一定含有NaNO2
C.根据现象3可推出该固体粉末中一定含有Na2SO4
D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3
D
【解析】
试题分析:A、由焰色反应为黄色可知该固体中含有钠元素,但不能判断是否含有钾元素,错误;B、红棕色气体是二氧化氮,说明该固体中含有N元素,但不能确定一定含有NaNO2,若固体中含有K2SO3、KNO3,加入稀盐酸后也会有NO产生,所以不能由现象2判断该固体粉末中一定含有NaNO2,错误;C、若固体中含有K2SO3、KNO3,加入稀盐酸后再加入氯化钡溶液,也会有硫酸钡的白色沉淀,所以不能由现象3推出该固体粉末中一定含有Na2SO4,错误;D、该固体中不溶于水的物质是FeO、Fe2O3,加入足量盐酸后,再加入KSCN溶液,溶液变红,说明溶液中一定存在铁离子,所以原固体中含有Fe2O3,加入K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中一定存在亚铁离子,所以原固体中一定含有FeO,正确,答案选D。
考点:考查对混合物的分析,离子的鉴定,实验现象的分析


科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期元素,原子序数依次增大。A是地壳中含量最高的元素,C是地壳中含量最高的金属元素,A、E同主族。D元素原子最外层电子数是次外层电子数的一半。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。
回答下列问题:
(1)元素A在元素周期表中的位置是 。
(2)写出B、E两元素形成化合物的电子式: ,所含化学键类型 ;
(3)A、D、E、F的气态氢化物的稳定性顺序 (用化学式表示)
(4)写出C、E对应的最高价氧化物的水化物相互反应的化学方程式是:
(5)C、D的氧化物与分别与B的氢氧化物反应的离子方程式: 、
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:填空题
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(2)各取5mL上述溶液,分别加热(温度相同),pH较小的是________溶液
(3)H2SO4溶液和NH4Cl溶液中由水电离出的c(H+)之比为__________
(4)取5mL NH4Cl溶液,加水稀释至50mL,c(H+) ____________ 10-6mol·L-1(填“>”、“<”或“=”),
c(NH4+)/c(H+)_______________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为原子序数依次增大的5种短周期元素。X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见气体甲。X、Y、Z 3种元素形成化合物乙。下列说法不正确的是 ( )
A.原子半径:W>Y>Z>M>X
B.化合物乙中一定只有共价键
C.由W元素形成的单质以及W与Z两元素形成的化合物都是原子晶体
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
下列生产工艺能体现“绿色化学”或节能环保思想的是( )
A.工业制氢气:用天然气发电再电解水制得
B.工业制硫酸:提高尾气排放的烟囱高度
C.工业制胆矾:使用向稀硫酸中吹空气并加热溶解铜
D.降低PM2.5:用油改煤技术,推广优质煤的使用范围
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
下列反应所得溶液中一定只含一种溶质的是
A.向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液
B.向稀硝酸中加入铁粉
C.向稀盐酸中滴入少量的NaAlO2溶液
D.向NaOH溶液中通入CO2气体
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:选择题
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
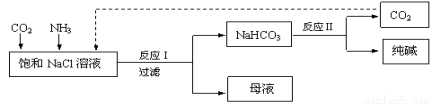
有关说法错误的是( )
A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O == NaHCO3↓ + NH4Cl
B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3
C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱
D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:填空题
(8分)已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:

(1)在一定温度下,测得硫蒸气的平均摩尔质量为80g/mol,则该蒸气中S2分子的体积分数不小于____。
(2)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH均表示生成1mol产物的数据)。
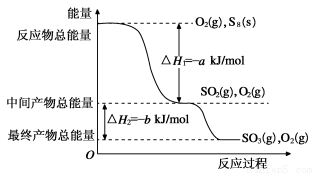
①写出表示S8燃烧热的热化学方程式________________________________________________。
②写出SO3分解生成SO2和O2的热化学方程式________________________________________。
③若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com