
| A. | 体系压强保持不变 | B. | 混合气体颜色保持不变 | ||
| C. | SO3和NO的体积比保持不变 | D. | 每消耗1molSO3的同时生成1molNO2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、反应前后气体两边的计量数相等,所以体系压强始终不变,故A错误;
B、混合气体颜色保持不变,则二氧化氮的浓度不变,正逆反应速率相等,说明达平衡状态,故B正确;
C、三氧化硫和一氧化氮的体积比始终是1:1,无法判断是否达到了平衡状态,故C错误;
D、表示的都是逆反应速率,无法判断正逆反应速率相等,无法判断各组分浓度是否不变,故D错误;
故选:B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:多选题
| A. | 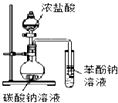 如图证明酸性:盐酸>碳酸>苯酚 | |
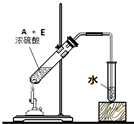
| B. | 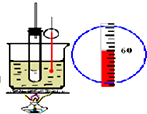 如图实验室制硝基苯 | |
| C. | 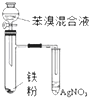 如图验证苯和液溴在催化剂作用下发生取代反应 | |
| D. | 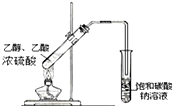 如图实验室制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 解释或结论 |
| A. | 过量的Fe粉中加入稀HNO3,充分反应后,滴加KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B. | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3氧化,形成致密的氧化膜 |
| C. | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| D. | 向紫色石蕊试液中通入SO2 | 溶液褪色 | SO2有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.25mol/L CaCl2溶液 | B. | 50ml 1mol/L KCl溶液 | ||
| C. | 50ml 0.5mol/L NaCl溶液 | D. | 200mL 0.25mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2Na+2H2O═4NaOH+H2↑ | D. | 2H2O═2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解过程中,a电极表面先有红色物质析出.后有气泡产生 | |
| B. | b电极上发生氧化反应.共产物为H2O和O2 | |
| C. | 曲线O-P段表示O2的体积变化,p-Q段表示H2的体积变化 | |
| D. | 从开始到Q点.共收集到0.1molH2和0.1molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以下为五种有机物的有关信息,根据表中信息回答问题.
以下为五种有机物的有关信息,根据表中信息回答问题.| A | B | D | E | F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶. | 其产量用来衡量一个国家的石油化工水平. | 比例模型为: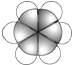 | ①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体. | 由5个原子组成的10个电子的共价分子. |
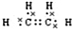 ,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)
,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)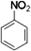 .
.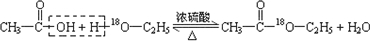 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com