
海水中含有大量化学物质,是巨大的化学资源宝库,利用海水资源可以获取一系列化 工产品。
工产品。

(1)请写出电解饱和食盐水的化学方程式:  。
。
(2)在 电解饱和食盐水的装置中,阴极产生的气体为 。
电解饱和食盐水的装置中,阴极产生的气体为 。
为了降低能耗,充分利用氯碱工业产品进行联合生产的方法得 到推广应用。
到推广应用。
根据上图,请回答下列问题:
(3)X气体为 (填化学式)。
(4)写出图中燃料电池负极的电极反应: 。
(5)若用浓硫酸处理钛铁矿,并向所得溶液中加入铁,则此时溶液中含有Fe2+、TiO2+和少 量Mg2+等阳离子。常温下,三种阳离子对应的氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。
量Mg2+等阳离子。常温下,三种阳离子对应的氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。

已知将上述处理液加水稀释后,立即析出大量白色沉淀,请写出该反应的离子方程式: 。
(6)已知:①Mg(s)+Cl2(s) MgCl2(s) ΔH=-641 kJ·mol-1
MgCl2(s) ΔH=-641 kJ·mol-1
②Ti(s)+Cl2(g) TiCl4(l) ΔH=-385 kJ·mol-1
TiCl4(l) ΔH=-385 kJ·mol-1
写出Mg与TiCl4反应的热化学方程式:  ;该反应过程中还应控制的反应条件是 。
;该反应过程中还应控制的反应条件是 。
规范答题:(1)2NaCl+2H2O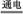 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)H2
(3)Cl2
(4)H2+2OH--2e- 2H2
2H2 O
O
(5)TiO2++2H2O TiO
TiO (OH)2↓+2H+
(OH)2↓+2H+
(6)2Mg(s)+TiCl4(l) 2MgCl2(s)+Ti
2MgCl2(s)+Ti (s) ΔH=-512 kJ·mol-1 隔绝空气
(s) ΔH=-512 kJ·mol-1 隔绝空气
解析:(2)电解池的阴极上阳离子放电得到H2。(3)由元素守恒知X中含有Cl元素,故X是阳极,生成物为Cl2。(4)Y为H2,该燃料电池是氢氧燃料电池,且电解质是NaOH溶液,负极上H2发生氧化反应。(5)由图像可知,随着酸性的减弱,生成的沉淀依次是TiO(OH)2、Fe(OH)2、Mg(OH)2,而TiO(OH)2是由TiO2 +所得。(6)Mg与TiCl4反应可生成MgCl2和Ti,即:2Mg+TiCl4
+所得。(6)Mg与TiCl4反应可生成MgCl2和Ti,即:2Mg+TiCl4 2MgCl2+Ti,方程式可由(①-②)×2得到,根据盖斯定律可知反应热为(-641 kJ·mol-1+385 kJ·mol-1)×2=-512 kJ·mol-1,由于Mg是活泼金属,加热条件下与氧气、N2反应,所以要隔绝空气。
2MgCl2+Ti,方程式可由(①-②)×2得到,根据盖斯定律可知反应热为(-641 kJ·mol-1+385 kJ·mol-1)×2=-512 kJ·mol-1,由于Mg是活泼金属,加热条件下与氧气、N2反应,所以要隔绝空气。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
(1)电镀是将镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如右图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法: 。
(3)酸浸法制取硫酸铜的流程示意图如下:
①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为 。
②步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
③在步骤(iii)发生的反应中,1molMnO2转移2 mol电子,该反应的离子方程式为:
。
④步骤(iv)除去杂质的化学方程式可表示为
3Fe3++NH4++2SO42-+6H2O=NH4Fe3(SO4)2(OH)6↓+6H+,过滤后母液的pH=2.0,
c(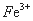 )=a mol·L—1,c(
)=a mol·L—1,c(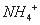 )=b mol·L—1,c(
)=b mol·L—1,c(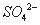 )=d mol·L—1,
)=d mol·L—1,
该反应的平衡常数K= (用含a、b、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:ClO –>I2>SO42– B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色 D.次氯酸钠可以与亚硫酸钠共存
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的数值,下列叙述正确的是
A.常温下,1mol丙烯中含碳原子数为3NA
B.常温下,pH=13的 NaOH溶液中含OH-数为NA
C.标准状况下,22.4LCHCl3中含C-H键数为NA
D.23g Na与足量氧气反应时转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.石油分馏、煤的气化、海水制食盐、蛋白质变性等过程都包含化学变化
B. 酸性氧化物一定不能和酸反应
C. 稀豆浆、硅酸、氯化铁溶液均为胶体
D.爆鸣气、铝热剂、玻璃、花生油、聚乙烯均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3·5H2O俗称“海波”,是常用的脱氯剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃和70 ℃时的溶解度分别为60.0 g和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2S O3+S
O3+S Na
Na 2S2O3
2S2O3
制备海波的流程:

(1)实验开始时 用1 mL乙
用1 mL乙 醇润湿硫粉的作用是 。
醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫黄的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是  。
。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液
C. 水 D.滤液
水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol·L-1的标准碘水 溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
I2+2Na2S2O3 2NaI+Na2S4O6
2NaI+Na2S4O6
产品中的Na2S2O3·5H2O的纯度为 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是( )
A.当V(NaOH)=20 mL时,溶液中离子浓度大小
关系:c(Na+)>c(HA-)> c(A2-) > c(H+) >c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2:1混合后,
其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH—)=c(H+)+c(HA–)+2c(H2A)
D.向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室中制备气体或验证气体性质的装置图

(1)写出用A制取氯气的化学方程式_________________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+
则装置B中的溶液的作用是___________________________________;
装置D中加的最佳试剂是(填序号)___________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________;
实验2不严谨之处应如何改进________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com