
 电解尿素的碱性溶掖可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列有关说法中不正确的是( )
电解尿素的碱性溶掖可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列有关说法中不正确的是( )| A. | 电解过穆中b极附近溶液碱性明显增强 | |
| B. | 溶液中的OH-逐渐向a极区附近移动 | |
| C. | 若在b极产生标准状况下224mL氢气,则消耗尿素2g | |
| D. | a极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O |
分析 该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极a是阳极,生成氢气的电极b是阴极,结合电解质溶液中氢氧根离子浓度的变化分析解答.
解答 解:A.该电池反应中,b极H元素化合价由+1价变为0价生成氢气,电极反应式为2H2O+2e-═H2↑+2OH-,所以b极附近溶液碱性明显增强,故A正确;
B.电解时,电解质溶液中阴离子向阳极移动,根据a极氮元素化合价由-3价变为0价失电子为阳极,所以氢氧根离子向a极移动,故B正确;
C.阴极b上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,标况下224mL H2物质的量为0.01mol,转移电子0.02mol,a极为阳极,电极反应式为:CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O,消耗尿素0.2g,故C错误;
D.电解时a极为阳极,电极反应式为:CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O,故D正确;
故选:C.
点评 本题考查了电解原理,明确元素化合价变化是解本题关键,根据元素化合价变化与阴阳极的关系来分析解答,难度中等.


科目:高中化学 来源: 题型:填空题
| 物 质 | 加入试剂 | 有关化学方程式 |
| NaHCO3 (Na2CO3)(溶液) | ||
| MgO(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “绿色化学”的核心是应用化学原理对环境污染进行治理 | |
| B. | “火树银花”中的焰火实质上是金属元素的焰色反应 | |
| C. | 李白有诗云“日照香炉生紫烟”这是描写“碘的升华” | |
| D. | 煤经过气化、液化和干馏等物理变化过程,可以转化为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
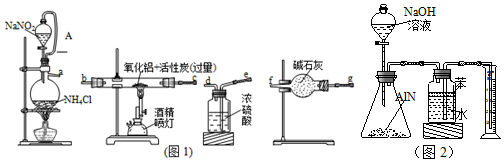
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 实验装置 | 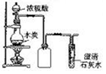 | 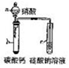 | 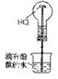 | 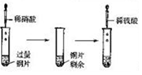 |
| 实验现象 | 试管中出现白色沉淀 | c装置中出现白色沉淀 | 红色喷泉 | 滴加稀硫酸、铜片溶解 |
| 实验结论 | 白色沉淀CaCO3 | 非金属性:N>C>Si | HCl极易溶于水 | 酸性条件下NO3-氧化性强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
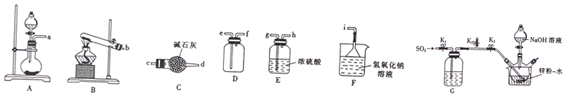
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBr全部转化为NaCl | B. | 10.3g NaBr参加了反应 | ||
| C. | 50%的Br-离子被还原 | D. | 16.15g固体由NaCl、NaBr和Br2组成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com