
25 ℃时,在浓度为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,测得其c(NH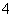 )分别为a、b、c(单位为mol·L-1)。下列判断正确的是( )
)分别为a、b、c(单位为mol·L-1)。下列判断正确的是( )
A.a=b=c B.a>b>c
C.a>c>b D.c>a>b
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:
2A(g)+B(g) 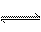 2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的压强是反应前的5/6,
2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的压强是反应前的5/6,
(1)达到平衡时,C的物质的量浓度;
(2)以B表示的该反应的速率;
(3)达到平衡时,A的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
在盐的水解过程中,下列叙述正确的是( )
A.盐的电离平衡被破坏
B.水的电离平衡被破坏
C.含有弱酸根离子的盐的水溶液一定显碱性
D.盐的水解程度主要取决于盐本身的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.05 mol·L-1的盐酸和未知浓度的NaOH溶液以12的体积比混合后,pH=12。用上述NaOH溶液滴定pH=3的一元弱酸HA的溶液20 mL,达到终点时消耗NaOH溶液12.5 mL。求:
(1)NaOH溶液的物质的量浓度。
(2)一元弱酸HA的物质的量浓度。
(3)一元弱酸HA的电离平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝—冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3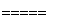 4Al+3O2↑
4Al+3O2↑
加入冰晶石的作用:____①____。
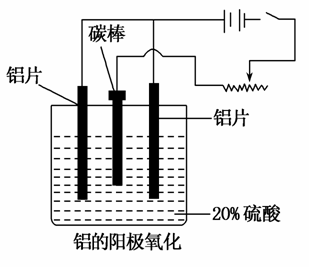
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________②________,下列可作阴极材料的是____③____。
A.铝材 B.石墨
C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为____④________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是____⑤________。
(5)下列说法正确的是____⑥____。(填选项字母)
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
将甲、乙两种有机物在常温常压下的混合物分离,已知它们的物理性质如下:
| 物质 | 密度/(g/cm3) | 沸点/℃ | 水溶性 | 溶解性 |
| 甲 | 0.789 3 | 78.5 | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
则应采用的分离方法是( )
A.分液 B.蒸馏 C.干馏 D.萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com