
向10.4g Fe3O4、Fe2O3、Cu的混合物中加入1 mol·L?1的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的H2在高温下还原相同质量的原混合物,固体减少的质量为( )
A.1.12g B.2.24g C.3.24g D.6.42g
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:推断题
(10分)短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D与A位于同一主族;在同周期元素形成的简单离子中,E的离子半径最小。
(1)实验室中可用A2C2制取C单质,其化学方程式是
(2)由A、C、D三种元素组成的化合物的电子式是 ;B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是 (用离子方程式表示)。
(3)反应乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是 (填“正”或“负”)极,在碱性条件下其电极反应是
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:实验题
(15分)乙酰苯胺为无色晶体,具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。在实验室制备乙酰苯胺常用苯胺与乙酸反应,反应方程式为:
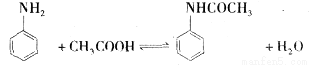
实验的具体操作步骤流程图:

相关的文献数据如下:
试剂名称 | 相对分子质量 | 密度g/ml | 熔点℃ | 沸点℃ | 溶解度 |
苯胺 | 93 | 1.02 | -6.2 | 184.4 | 稍溶于水,与乙醇、乙醚、苯混溶 |
乙酸 | 60 | 1.05 | 16.7 | 118 | 溶于水、乙醇、乙醚等 |
乙酰苯胺 | 135 | 1.21 | 114~116 | 280~290 |
|
据此回答下列问题:
(1)实验时将苯胺、乙酸和锌粉放在单口圆底烧瓶中进行混合加热,所选单口圆底烧瓶的最佳规格是
A. 50mL B. 100mL C. 150mL D. 200mL
(2)量筒所接的蒸馏物是__________(填化学式)。实验这样设计的目的是__________。
(3)通过重结晶提纯产物,则乙酰苯胺在水中溶解性的变化特征是_________________。
(4)对无色片状晶体进行干燥,判断晶体干燥完全的实验方法是___________________。
(5)锌粉几乎不与纯净的乙酸反应,但随着上述制备乙酰苯胺的反应而会消耗乙酸,原因是_____。
(6)实验所得无色片状晶体干燥后称量目标产物质量为4.0g,请计算所得到乙酰苯胺的产率是___。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省盟校高三第二次联考理综化学试卷(解析版) 题型:选择题
固体电解质是通过离子迁移传递电荷。如RbAg4I5晶体,其中迁移的物种全是Ag+,利用RbAg4I5晶体,可以制成电化学气敏传感器,下图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。在气体传感器工作过程中,下列变化肯定没有发生的是( )
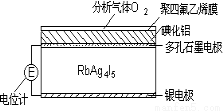
A.Ag-e-=Ag+ B.I2+2Ag++2e-=2AgI
C.I2+2Rb++2e-=2RbI D.4AlI3+3O2=2Al2O3+6I2
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省协作体高三第二次联考理综化学试卷(解析版) 题型:填空题
【化学—物质结构与性质】(15分)
许多金属及它们的化合物在科学研究和工业生产中具有许多用途.回答下列有关问题:
(1)基态Ni核外电子排布式为________________, 第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________________;
(2)①已知CrO5中Cr为+6价,则CrO5的结构式为 。
②金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,与Ni(CO)n中配体
互为等电子体的离子的化学式为 (写出一个即可)。
③铜是第四周期最重要的过渡元素之一,其单质及化合物有广泛用途。已知CuH晶
体结构单元如图所示。该化合物的的密度为ρg/cm3,阿伏加德罗常数的值为NA,则
该晶胞中Cu原子与H原子之间的最短距离为 cm(用含ρ和NA的式子表示)。
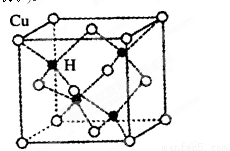
(3)另一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为__________,若该晶胞的边长为a pm,则合金的密度为_________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省协作体高三第二次联考理综化学试卷(解析版) 题型:选择题
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是 ( )
A.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应
B.可用FeCl3 溶液区别乙酰水杨酸和贝诺酯
C.贝诺酯分子中有2种含氧官能团
D.贝诺酯与足量NaOH 溶液共热,生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:填空题
(14分)(Ⅰ)、A、B、C、D、E、五种元素均是短周期元素,且原子序数依次增大。B、E原子的最外层电子数均为其电子层数的2倍。D、E元素原子的最外层电子数相等。X、Y、Z、W、G、甲、乙七种物质均由上述中的两种或三种元素组成。元素B形成的单质M与甲、乙(相对分子质量:甲<乙)浓溶液的反应分别是:甲与M反应生成X、Y、Z,乙与M反应生成Y、Z、W,反应条件均省略。回答下列有关问题:
⑴X、Y、W均能与Z反应,若将标准状况下的X和D2按4:1充满试管后将其倒立于水槽中,待水不在上升时,试管内溶质的物质的量浓度是 (假设溶质不扩散)
⑵若将X、W、D2按4:4:3通入Z中充分反应,写出总的离子方程式
⑶G是一种既能与强酸又能与强碱反应的酸式盐,则G的电子式 ,取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温剩余溶液中离子浓度的由大到小顺序是 ,此时测得溶液的PH=12,则此条件下G中阴离子的电离平衡常数Ka =
(Ⅱ)⑷某温度时,向AgNO3溶液中加入K2CrO4溶液会生成
Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。
该温度下,下列说法正确的是_________。

A. Ag2CrO4的溶度积常数(Ksp)为1×10-8
B. 含有大量CrO 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+
C. a点表示Ag2CrO4的不饱和溶液,蒸发可以使溶液由a点变到b点
D. 0.02mol·L-1的AgNO3溶液与0.02mol·L-1的Na2CrO4溶液等体积混合会生成沉淀
⑸若常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至_______。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省宜春市高三模拟考试理综化学试卷(解析版) 题型:选择题
香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是:( )
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物碱性:X>Z
D. XR2、WR2两化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高一文理分科测试化学试卷(解析版) 题型:选择题
下列有关物质性质的说法错误的是
A.热稳定性:HCl> HI B.原子半径:Na> Mg
C.结合质子能力:S2-> Cl- D.酸性:H2SO3>H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com