
【化学———化学与技术】
锶(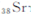 )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
和 同属于第ⅡA族?
同属于第ⅡA族?
(1)碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 ?
(2)碳酸锶是最重要的锶化合物?用含SrSO4和少量BaSO4?BaCO3?FeO?Fe2O3?Al2O3?SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3?
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH 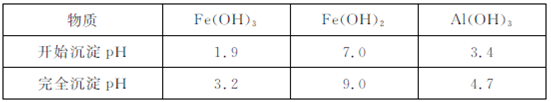
①Ⅰ中,反应的化学方程式是 ?
②Ⅱ中,能与盐酸反应溶解的物质有 ?
③Ⅳ的目的是 ?
④该工艺流程中NH4HCO3含有的化学键是 ?
(1)< 同一主族元素,原子最外层电子数相同
(2) ①SrSO4+Na2CO3=SrCO3+Na2SO4 ②SrCO3 BaCO3 FeO Fe2O3 Al2O3
③将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全 ④离子键?共价键
解析试题分析: (1)金属性Sr<Ba,则碱性:Sr(OH)2<Ba(OH)2,锶的化学性质与钙和钡类似,是因同一主族元素,原子最外层电子数相同,
故答案为:<;同一主族元素,原子最外层电子数相同;
(2)①I中只有SrSO4与碳酸钠溶液反应,反应为SrSO4+Na2CO3=SrCO3+Na2SO4,故答案为:SrSO4+Na2CO3=SrCO3+Na2SO4;
②由物质的溶解性可知,只有碳酸盐和金属氧化物与盐酸反应,则SrCO3、BaCO3、FeO、Fe2O3、Al2O3均与盐酸反应,
故答案为:SrCO3、BaCO3、FeO、Fe2O3、Al2O3;
③由生成氢氧化物沉淀的pH可知,Ⅳ的目的是将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全,故答案为:将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全;
④NH4HCO3为离子化合物,含铵根离子与碳酸氢根离子之间的离子键、还含N-H、C-O等共价键,即含离子键、共价键,故答案为:离子键、共价键.
考点: 考查物质的分离提纯方法及选择的相关知识点。


科目:高中化学 来源: 题型:单选题
1898年,IUPAC(International Union of Pure and Applied Chemistry,国际纯粹与应用化学联合会)建议用1~18列代替原周期表中主族、副族序号,请问原第IVA族应该在第几列?
| A.第4列 | B.第14列 |
| C.第5列 | D.第15列 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
| A | | C |
| | B | |
 反应的化学方
反应的化学方 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(第1小题1分,其余每空2分,共11 分)
短周期元素A、B、C、D中,0.5 mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4 g A的氧化物恰好与100 mL 0.2 mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素是第二周期中原子半径最小的元素,C2-比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)B元素的名称是 。
(2)画出D和C2-的结构示意图 。______________________。
(3)将B元素形成的单质通入水中反应的化学方程式为_________________________, B、C、D三种元素形成的氢化物中稳定性最强的是_______(填写化学式,下同),最高价氧化物的水化物酸性最强的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)运用物质结构的知识完成下列问题。
(1)第一电离能介于B、N之间的第二周期元素有 (填元素符号)。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
Q R
①晶体Q中不存在的作用力为 (填字母)。
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如下图3所示。则m= (填数字)。
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如下图4)所有顶点的氮原子,这种碳氮化钛化合物的化学式为 。

图3 图4
(6)部分化学键的键能见下表:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com