
| A. | CO32-+Ba2+=BaCO3 | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-→H2O+BaCO3 | |
| D. | 2HCO3-+Ba2++OH-=BaCO3+2H2O+CO32- |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
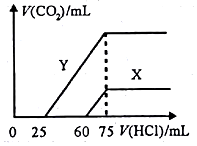
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2=3:1 | |
| B. | 平衡时.Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率不相等 | |
| D. | c1 的取值范围为 0 mol/L<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.
铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z与Y、Z与W形成的化合物的化学键完全相同 | |
| B. | X与Y组成的简单氢化物的沸点高于X与R组成的简单氢化物的沸点,是因为非金属性Y>R | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | Y、Z、W三种元素组成的化合物的水溶液可能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:W>Z>X | |
| B. | 单质熔点:W>Z | |
| C. | 最高正价:W>X>Y>Z | |
| D. | W、X、Z最高价氧化物对应的水化物相互之间能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题:
A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题: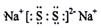 ,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.
,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | Y | Z | W |
| 性质 结构 信息 | 工业上常用电解熔融XW2制取X的单质. | Y的最外层电子数比最内层电子数多1. | Z的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂. | W的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强. |
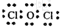 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com