考点:真题集萃,氧化还原反应方程式的配平,反应热和焓变,热化学方程式,卤素原子结构及其性质的比较
专题:氧化还原反应专题,化学反应中的能量变化,卤族元素
分析:(1)与氯元素同族的短周期元素是F原子,F原子核外有2个电子层,最外层有7个电子,据此书写F的原子结构示意图;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强;
(3)工业上,通过如下转化可制得KClO
3晶体:NaCl溶液
NaClO
3溶液
KClO
3晶体,
①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;
两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出;
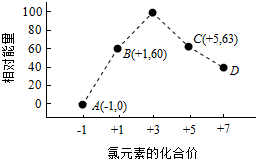
(4)一定条件下,在水溶液1 mol Cl
-、ClO
x-(x=1,2,3,4,)的能量(kJ)相对大小如图所示.
①D中Cl元素化合价为+7价,据此判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO
-=ClO
3-+2Cl
-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol.
解答:
解:(1)与氯元素同族的短周期元素是F原子,F原子核外有2个电子层,最外层有7个电子,则F的原子结构示意图为
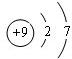
,故答案为:
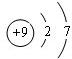
;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故选bc;
(3)工业上,通过如下转化可制得KClO
3晶体:NaCl溶液
NaClO
3溶液
KClO
3晶体,
①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气,所以反应方程式为1NaCl+3H
2O═1NaClO
3+3H
2↑,
故答案为:1;3;1;3;H
2↑;
②NaClO
3转化为KClO
3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO
3在水中的溶解度明显小于其它晶体,所以先析出KClO
3,
故答案为:复分解反应;室温下KClO
3在水中的溶解度明显小于其它晶体;
(4)①根据图象知,D中Cl元素化合价为+7价,所以ClO
x-中x为4,则D为ClO
4-,故答案为:ClO
4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO
-=ClO
3-+2Cl
-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以该热化学反应方程式为3ClO
-(aq)=ClO
3-(aq)+2Cl
-(aq)△H=-117kJ/mol,故答案为:3ClO
-(aq)=ClO
3-(aq)+2Cl
-(aq)△H=-117kJ/mol.
点评:本题以卤族元素为载体考查了氧化还原反应、热化学反应、非金属强弱的判断方法等知识点,根据物质的性质、原子结构结合元素周期律等知识点来分析解答,题目难度中等.

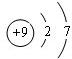 ,故答案为:
,故答案为: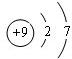 ;
;

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
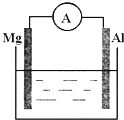 (1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为
(1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为
 I.下列有关实验的说法不正确的是
I.下列有关实验的说法不正确的是