
| A. | 向NaOH溶液中滴加盐酸至完全中和 | |
| B. | 向Ba(OH)2溶液中滴加盐酸至完全中和 | |
| C. | 向Ba(OH)2溶液中滴加硫酸至完全中和 | |
| D. | 向BaCl2溶液中滴加AgNO3至沉淀完全 |
分析 溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化,离子浓度减小,导电能力减小,离子浓度增大,导电能力增大,据此分析.
解答 解:A.HCl、NaOH为强电解质,向NaOH溶液中滴加盐酸至完全中和,反应生成NaCl和水,NaCl为强电解质,离子浓度、电荷相同,则导电性基本不变,故A不选;
B.Ba(OH)2、HCl为强电解质,向Ba(OH)2溶液中滴加盐酸至完全中和,反应生成氯化钡和水,氯化钡为强电解质,离子所带电荷的浓度相同,则导电性基本不变,故B不选;
C.Ba(OH)2为强电解质,加入硫酸,反应生成硫酸钡和水,硫酸钡难溶于水,溶液中离子浓度很小,溶液导电性减小,故C选;
D.向BaCl2溶液中滴加AgNO3至沉淀完全,生成氯化银和硝酸钡,溶液中电荷的浓度基本不变,导电性基本不变,故D不选;
故选C.
点评 本题考查溶液的导电性,题目难度不大,明确电解质的强弱、发生的化学反应及溶液中自由移动的离子浓度的变化即可解答


科目:高中化学 来源: 题型:选择题
| A. | 萃取、分液前需对分液漏斗检漏 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层液体则从上口倒出 | |
| C. | 为保证分液漏斗内的液体顺利流出,需将分液漏斗上面的塞子打开 | |
| D. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+ )+c(M+ )=c(OH- )+c(A- ) | |
| B. | pH 相等的 NaHCO3、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(NaHCO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO- )+2c(OH- )=2c(H+ )+c(CH3COOH) | |
| D. | 0.1mol•L-1 的NaHA溶液,其pH=4:c(HA- )>c(H+ )>c(H2A)>c(A2- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Cu2+、Fe2+氧化性依次减弱 | |
| B. | 可发生反应:Fe+2Fe3+═2Fe2+ | |
| C. | Fe、Fe2+、Cu还原性依次减弱 | |
| D. | 将铁、铜混合粉末放入FeCl3溶液中,铁粉先溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | SO2溶于水形成的溶液能导电 | SO2是电解质 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键的键角是109.5° |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且由于有氢键的影响 |
| D | HF的沸点高于HCI | H-F的键长比H-CI的键长短 |
| A. | SO2溶于水形成的溶液能导电SO2是电解质 | |
| B. | 白磷为正四面体分子白磷分子中P-P键的键角是109.5° | |
| C. | 1体积水可以溶解700体积氨气氨是极性分子且由于有氢键的影响 | |
| D. | HF的沸点高于HCIH-F的键长比H-CI的键长短 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
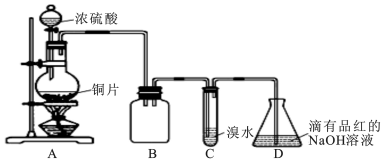
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将铁块放入浓H2SO4中 | 无明显现象发生 | 铁常温下与浓H2SO4不反应 |
| B | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均发生了分解 |
| C | 氯水滴入混有KSCN的FeCl2溶液 | 溶液显红色 | 该氯水不具有漂白性 |
| D | 向溶液Y中先加盐酸酸化,无现象,再加入BaCl2溶液 | 白色沉淀 | Y中一定含SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
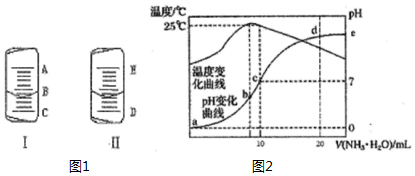 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.| 实验编号 | 待测CH3COOH溶液的体积/mL | NaOH溶液的体积/mL |
| 1 | 20.00 | 24.01 |
| 2 | 20.00 | 23.99 |
| 3 | 20.00 | 22.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com