
分析 ①漂粉精的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙,利用氯气与石灰乳为原料制备漂粉精;
②实验室制备Cl2:二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
③二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,根据离子反应方程式的书写规则书写该离子反应方程式;
④等物质的量的Cl2和SO2混合发生氧化还原反应生成盐酸和硫酸;
⑤二氧化硫与硫化氢发生氧化还原反应生成硫单质和水;
⑥二氧化氮与水反应生成一氧化氮和硝酸;
⑦实验室利用氢氧化钙与氯化铵共热制取氨气;
⑧Cu与稀硝酸反应生成硝酸铜、NO与水,据此书写离子方程式.
解答 解:①漂粉精的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②实验室用二氧化锰与浓盐酸在加热条件下制取氯气,两者发生氧化还原反应,锰从+4价变为+2价,氯从-1价变为0价,化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
③实验室用二氧化锰与浓盐酸在加热条件下制取氯气,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应改写为离子方程式时氧化物、单质、水、难溶物质要写成化学式的形式,则其离子方程式为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
④Cl2具有氧化性,SO2具有还原性,SO2气体与氯水混合两者发生氧化还原反应生成盐酸和硫酸,反应的离子方程式为SO2+H2O+Cl2═2Cl-+4H++SO42-,
故答案为:SO2+H2O+Cl2═2Cl-+4H++SO42-;
⑤硫化氢与二氧化硫发生硫元素的价态归中反应,反应生成硫单质,反应的化学方程式为:2H2S+SO2=2H2O+3S↓,
故答案为:2H2S+SO2=2H2O+3S↓;
⑥二氧化氮与水反应,N元素的化合价由+4价变为+5价HNO3和+2价NO,反应的化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
⑦铵盐和碱反应能生成氨气,实验室利用氢氧化钙与氯化铵共热制取氨气,该化学反应为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
⑧Cu与稀硝酸反应,铜被氧化成+2价,生成硝酸铜,氮为还原为+2价生成NO,反应离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O.
点评 本题考查了化学方程式、离子方程式的书写,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力及综合应用能力,注意掌握化学方程式、离子方程式的书写原则.


科目:高中化学 来源: 题型:解答题
 ;
;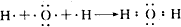 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
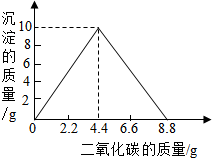 某实验小组在含一定量Ca(OH)2的澄清石灰水中通入CO2,产生沉淀的质量与通入CO2气体的质量的关系如图所示,回答下列问题:
某实验小组在含一定量Ca(OH)2的澄清石灰水中通入CO2,产生沉淀的质量与通入CO2气体的质量的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性A>B>D | |
| B. | B和C形成的化合物中可能有共价键 | |
| C. | 原子序数D>C>A>B | |
| D. | 四种元素中,最高价氧化物对应的水化物酸性最强的是B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )| A. | 阴极的电极反应式为:Cl-+2OH--2e -=ClO-+H2 O | |
| B. | 阳极的电极反应式为:2CN-+12OH--10e-=N2↑+2CO 32-+6H2O | |
| C. | 电解时使用锂钒氧化物二次电池(V2O5+xLi$?_{充电}^{放电}$LixV2O5)做电源,电池充电时a 电极的电极反应式为:LixV2O5_xe-=V2O5+xLi+ | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
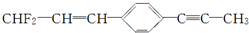 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 该有机物物质的类别为:卤代烃、烯烃、炔烃 | |
| B. | 该有机物分子式:C12H9F2 | |
| C. | 最多有8个碳原子在同一直线上 | |
| D. | 12个碳原子有可能都在同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com