
下列事实或现象与胶体性质无关的是
A.向三氯化铁溶液中加入NaOH溶液出现红褐色沉淀
B.煮沸的 FeCl3溶液冷却后,用一束光照射,有一条光亮的通路
C.胶态金属氧化物分散于玻璃中制成有色玻璃
D.明矾溶于水可以用来净水
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2016届河北正定中学高三上学期第五次月考理科综合化学试卷(解析版) 题型:选择题
已知:下表为25℃时某些弱酸的电 离平衡常数。
离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
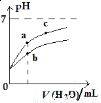
右图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+ H2O =HClO+CO32-
C.图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源:2015-2016北京大学附中宇华教育集团高二12月化学卷(解析版) 题型:实验题
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高一上12月月考化学卷(解析版) 题型:选择题
在含有Cu(NO3)2、Zn(NO3)2、、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1molFe粉,充分搅拌后铁溶解,溶液中不存在Fe3+离子,同时析出0.1molAg。则下列结论中不正确的是
A.溶液中Cu2+与Fe2+的物质的量之比为1:2 B.Fe3+的氧化性大于Cu2+
C.氧化性:Ag+>Cu2+>Fe3+>Zn2+ D.1molFe可还原2molFe3+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上期中测试化学试卷(解析版) 题型:填空题
(1)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 。
(2)标准状况下有① 6.72 L CH4 ② 3.01×1023个HCl ③ 13.6 g H2S ④ 0.2 mol NH3四种气体,气体所占体积由小到大的顺序是(填序号,下同) ;所含氢原子数由小到大的顺序是 。
(3)已知某植物营养液配方为0.3 mol KCl,0.2 mol K2SO4,0.1 mol ZnSO4和1 L水。若以KCl,K2SO4,ZnCl2和1 L水为原料配得相同组成的营养液,需三种溶质KCl mol,K2SO4 mol,ZnCl2 mol。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:填空题
(1)①CaCO3(s) == CaO(s) + CO2(g);ΔH=177.7kJ/mol
②C(s) + H2O(g)== CO(g) + H2(g);ΔH= -131.3kJ/mol
③0.5H2SO4(l) + NaOH(l) == 0.5Na2SO4(l) + H2O(l);ΔH= -57.3kJ/mol
④C(s) + O2(g) == CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(g) == CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) == NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) == 2H2O(l);ΔH= -517.6kJ/mol
(a)上述热化学方程式中,不正确的有
(b)根据上述信息,写出C转化为CO的热化学方程式_ 。
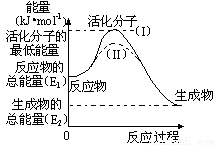
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g) △H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则其逆反应的活化能为 
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为________(阿伏加德罗常数用NA表示),放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)下列措施对增大反应速率明显有效的是:
A.硫化钠溶液与草酸溶液放出硫化氢气体
B.碱金属Cs与水反应时增大水的用量
C.Fe与稀硫酸反应制取氢气时,改用浓硫酸
D.Al与盐酸反应,加几滴氯化铜溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
室温下,某氨水pH=x,某盐酸pH=y,已知x+y=14,且x>11。将上述氨水、盐酸等体积混合后,所得溶液中各种离子浓度由大到小的顺序正确是
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.c(Cl-)=c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第四次月考化学试卷(解析版) 题型:选择题
1mol某气态烃最多可与2mol的HCl发生加成反应,所得产物与Cl2发生取代反应,若将氢原子全部取代,需要8mol的Cl2,则该烃的结构简式可能为( )
A.CH≡CH B.CH3-C≡CH
C.CH3-CH=CH- CH3 D.CH3-C≡C- CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com