
| A. | 该气体中肯定含有SO2 | B. | 该气体中肯定含有H2S和SO2 | ||
| C. | 该气体中肯定含有SO2和CO2 | D. | 该气体中肯定含有H2S、CO2和HI |
分析 无色气体,一定没有红棕色的NO2气体;氯水为黄绿色,将其通入氯水中,得无色透明溶液,一定没有HI、H2S;说明溶液中一定有SO2,因为SO2+Cl2+2H2O═2HCl+H2SO4.可能存在的气体为:HCl、CO2,据此进行判断.
解答 解:由于是无色气体,所以一定没有红棕色的气体NO2;将气体通入氯水中,得到无色溶液,由于碘离子能够被氯气氧化成有色的碘单质,一定不存在HI气体;由于硫离子能够被氯气氧化成有色的硫单质沉淀,一定不存在H2S气体,氯水为黄绿色,将气体A通入氯水中得无色透明溶液,说明溶液中一定有SO2,因为SO2+Cl2+2H2O═2HCl+H2SO4,不能确定原气体含氯化氢,所以一定存在的气体为:SO2;一定不存在的气体为:H2S、HI、NO2;可能存在的气体为:HCl、CO2,
A.根据分析可知,原气体中一定SO2,故A正确;
B.该气体中肯定不含有H2S,一定含有SO2,故B错误;
C.题干信息无法判断是否含有CO2,故C错误;
D.根据以上分析可知,题干信息无法判断是否含有CO2,但一定不存在的气体为:H2S、HI,故D错误;
故选A.
点评 本题考查常见气体的检验,掌握常见化合物的性质以及常见气体的检验方法是解题的关键,试题侧重对学生基础知识的训练和检验.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| B. | 在反应KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3 mol Cl2转移电子数为6NA | |
| C. | SiO2与烧碱反应只生成盐和水,属于酸性氧化物 | |
| D. | 1 mol Cl2通入足量的水中,可生成1 mol HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
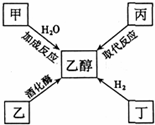
| A. | 甲是乙烯 | B. | 乙可能是葡萄糖 | ||
| C. | 丙一定是CH3CH2X (X是卤素原子) | D. | 丁十H2→乙醇的反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com