
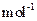 :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71) 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:不详 题型:单选题
| | 相关实验 | 预期目的 | ||||||||||||||
查看答案和解析>> 科目:高中化学 来源:不详 题型:实验题 有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸直接反应,即Cu 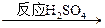 CuSO4。②由Cu CuSO4。②由Cu CuSO4,试回答: CuSO4,试回答:(1)写出有关的化学反应方程式_______________、_______________、___________。(3分) (2)这两种方案,你认为哪一种方案较合理?(1分) (3)请说明选择合理方案的理由。(2分) 查看答案和解析>> 科目:高中化学 来源:不详 题型:实验题 (12分)“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验: (1)打开这种药片的密封膜,发现其外观为淡黄色。 (2)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色。学生甲由此断定“速力菲”的主要成分是三价铁盐。 (3)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口。结果发现:溶液仅显示淡红色。乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐。 (4)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:  试完成下列问题: (1)甲、乙两位同学的结论中比较正确的是________,另一同学的结论不合理的原因是 ________________________。 (2)丙的实验①说明维生素C具有较强的________性(填“氧化”或“还原”)。 (3)写出与②中现象对应的离子反应方程式________________________________。 (4)关于③中的实验现象,丙同学提出了两种假设:一种是过量的双氧水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的双氧水将SCN-氧化了。请你设计一个实验方案以确认哪种假设更合理________________________________。 (5)针对实验目的,本次实验尚未完成的任务是__________________。 查看答案和解析>> 科目:高中化学 来源:不详 题型:实验题 小军在实验室里做了下列实验: ①分别向盛有稀硫酸和稀盐酸的试管中,滴加紫色石蕊试液;②向盛有稀硫酸的试管中,滴加氢氧化钠试液;③向盛有锌粒的试营中,分别滴加稀盐酸和稀硫酸;④将一根生锈的铁钉分别放入盛有稀盐酸和稀硫酸的试管中,过一会儿取出。 他在纸上记录了以下现象: a. 溶液没有明显现象;b. 溶液变为黄色;c. 溶液显红色;d. 产生气泡,溶液无色。 下面请你来整理完成实验报告。 (1)实验目的:探究__________(填写物质类别)的化学性质。 (2)实验现象:产生a现象的实验所对应的一类反应通常被我们称作__________反应(该反应属于复分解反应)。 (3)上题所涉及的这类反应在日常生活和工农业生产中有广泛的应用。请举出一个利用该反应的实例:______________________________。 查看答案和解析>> 科目:高中化学 来源:不详 题型:单选题 以下实验或操作不能达到目的的是
查看答案和解析>> 科目:高中化学 来源:不详 题型:实验题  某研究性小组借助A-D的仪器装置完成有关实验 某研究性小组借助A-D的仪器装置完成有关实验   【实验一】收集NO气体。 【实验一】收集NO气体。(1)  用装置A收集NO气体,正确的操作上 (填序号)。 用装置A收集NO气体,正确的操作上 (填序号)。 a.从①口进气,用排水法集气 b.从①口进气,用排气法集气 a.从①口进气,用排水法集气 b.从①口进气,用排气法集气 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气 【实验二】为了探究镀锌薄铁板上的锌的质量分数 【实验二】为了探究镀锌薄铁板上的锌的质量分数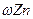 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。 (2)选用B和 (填仪器标号)两个装置进行实验。 (2)选用B和 (填仪器标号)两个装置进行实验。 (3)测得充分反应后生成氢气的体积为VL(标准状况), (3)测得充分反应后生成氢气的体积为VL(标准状况),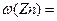 = 。 = 。 (4)计算镀层厚度,还需要检索的一个物理量是 。 (4)计算镀层厚度,还需要检索的一个物理量是 。 (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。 (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。 (6) (6)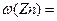 。 。 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。 (7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。 (7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。查看答案和解析>> 科目:高中化学 来源:不详 题型:单选题 下列物质中含原子个数为阿伏加德罗常数个的是( )
查看答案和解析>> 科目:高中化学 来源:不详 题型:单选题 实验室有一瓶久置的白色粉末,元素分析证明它由钾、硫、氧三种元素组成,钾和硫的 质量比为39∶16,下列结论正确的是
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |