
【题目】对外加电流的金属保护中,被保护的金属( )
A. 与电源的正极相连 B. 表面上发生氧化反应
C. 与电源的负极相连 D. 与另一种活泼性较差的金属相连
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】硫酸厂的烧渣主要成分是Fe2O3,其次含少量的SiO2和FeS。工业上利用硫酸厂烧渣经回收处理制得绿矾(FeSO4·7H2O)和一种聚铁胶体[Fe(OH)SO4]n。绿矾是治疗缺铁性贫血药品的重要成分,而聚铁胶体是重要的水处理剂。上述生产工艺流程如下:
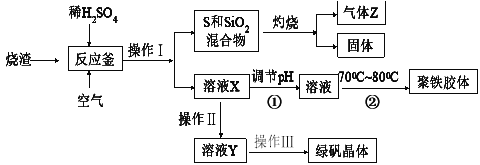
请通过分析回答下列相关问题:
(1)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是_______________:
A.用氨水吸收 B. 直接用水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(2)操作Ⅲ是_____________、_______________、过滤、洗涤、干燥保存等;
(3)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是___________________。
(4)在反应釜中FeS、O2及稀H2SO4反应硫酸铁等物质,则反应的离子方程式为___________________________;
(5)某研究性小组为探究绿矾(相对分子质量:278)在隔绝空气条件下加热分解反应的产物(已知分解产物全为氧化物),进行了如图所示的实验:
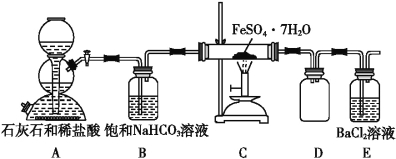
① 实验开始时,在点燃C处酒精喷灯之前应先打开活塞通CO2,其目的是_____________。 装置D的作用是______________________。
②该组同学设计的装置存在着一个明显的缺陷是____________________________。
③该组同学称取55.6 g绿矾按上图装置进行实验。待绿矾分解完全后,E瓶中产生了23.3 g白色沉淀。将C中固体产物投入足量稀硫酸中完全溶解得到溶液,取少量该溶液滴入KSCN溶液呈红色;另取少量该溶液滴入酸性KMnO4溶液,KMnO4溶液不褪色。据写出绿矾分解的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________ mol/L。
(5)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
A.混合物:空气、矿泉水、水银
B.酸性氧化物:、CO2、SO2、CO
C.盐:醋酸钠、氯化铵、纯碱
D.弱电解质:CH3COOH,H2O,NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
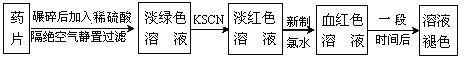
①实验室在配制稀硫酸溶液时,下列操作可造成配制结果偏高的是________________。
A.采用仰视的方式量取浓硫酸 |
B.容量瓶在使用前未干燥,里面有少量蒸馏水 |
C.定容时,俯视容量瓶刻度线 |
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度 |
②“服用维生素C,可防止二价亚铁离子被氧化”,由此可见维生素C具有_________性。
③加入KSCN溶液后,在未加新制氯水前,溶液中也产生红色,其可能的原因是 。
④加入氯水后发生的反应的离子方程式为 、 。
⑤在实验中发现放置一段时间,溶液的颜色会逐渐褪去。请你对溶液褪色的原因作出3种猜想。
编号 | 猜 想 |
甲 | |
乙 | |
丙 |
(2)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O 为片剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某样品含有碳酸钠及少量的硫酸钠和氯化钠,某学生为了检验其中的阴离子,按照右图程序进行实验,所加试剂均过量。(可供选择的试剂有:稀硫酸、稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液)
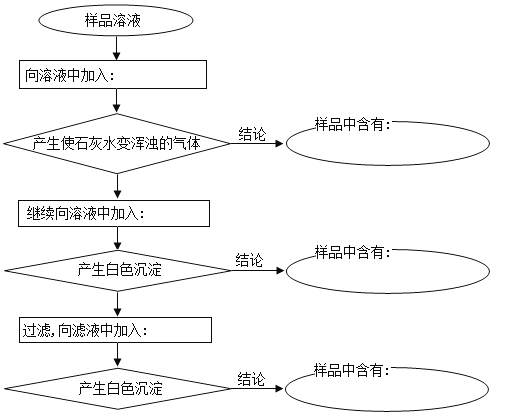
(1)请将所加试剂及有关结论的化学式填写在相应的空格中。
① ② ③
④ ⑤ ⑥
(2)写出加入试剂①反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X、Y、Z三种物质存在如图所示转化。回答下列问题。
若X为黑色固体单质,A为O2,写出Z→Y的化学方程式_________________。
②若X为NaOH溶液,则写出Y→Z的化学方程式_______________________。
(2)已知常温下在溶液中可发生如下两反应:
Ce4++Fe2+=Fe3++Ce3+;Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Ce4+、Sn4+、Fe3+三种离子的氧化性由强到弱的顺序是 。
(3)Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程。
①该反应中,被氧化的元素是_____________,氧化剂是_______________。
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ ______+ ________![]() ______+ ________+ H2O
______+ ________+ H2O
反应中若产生0.2mol的还原产物,则有_______mol电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镀锌铁在发生析氢腐蚀时,若有0.2 mol 电子发生转移,下列说法正确的是( )
①有5.6 g金属被腐蚀
②有6.5 g金属被腐蚀
③在标准状况下有2.24 L气体放出
④在标准状况下有1.12 L气体放出
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于吸热反应的说法,错误的是
A. 需要加热的反应不一定是吸热反应
B. 多数分解反应是吸热反应
C. 吸热反应一定不能自发进行
D. 盐类的水解反应一定是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com