

| A. | 利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰 | |
| B. | 1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 | |
| C. | 两种兴奋剂最多都能和含3molNaOH的溶液反应 | |
| D. | 两种分子中的所有碳原子均不可能共平面 |
分析 A.利尿酸分子中含氧官能团分别是羰基、醚键和羧基,有几种氢原子就有几个吸收峰;
B.兴奋剂中含有碳碳双键、酚羟基,碳碳双键和苯环上酚羟基邻对位氢原子能和溴发生反应;
C.酚羟基、酯基、氯原子和羧基能和氢氧化钠反应;
D.碳碳双键、连接苯环的碳原子能共面.
解答 解:A.利尿酸分子中含氧官能团分别是羰基、醚键和羧基,利尿酸中氢原子种类有7种,有7个吸收峰,故A错误;
B.兴奋剂中含有碳碳双键、酚羟基,碳碳双键和苯环上酚羟基邻对位氢原子能和溴发生反应,所以1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2,故B正确;
C.酚羟基、氯原子和羧基能和氢氧化钠反应,所以两种兴奋剂最多都能和含5molNaOH的溶液反应,故C错误;
D.碳碳双键、连接苯环的碳原子能共面,所以兴奋剂X中所有碳原子能共面,故D错误;
故选B.
点评 本题考查有机物结构和性质,侧重考查酚、卤代烃、羧酸的性质,明确官能团及其性质关系是解本题关键,难点是判断原子共面,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
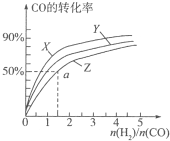 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,40 g SO3所含的氧原子的数目为1.5 NA | |
| B. | 5.6 g铁与足量氯气或硫蒸气反应转移的电子数均为0.3 NA | |
| C. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| D. | 常温下5.6 g铁投入到足量浓硝酸中反应,转移电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;DB2有多种重要的用途,请你写出其中的一种:制玻璃、制光导纤维、制粗硅(其中一种).
;DB2有多种重要的用途,请你写出其中的一种:制玻璃、制光导纤维、制粗硅(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| D | ||
| A | B | C |
| E |
| A. | 5Z | B. | 5Z+8 | C. | 5Z+10 | D. | 5Z+18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,B中具有的官能团的名称酯基、溴原子.
,B中具有的官能团的名称酯基、溴原子.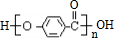 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | Y | Z | W |
| 相关信息 | 短周期p区元素,有种单质常作电极材料 | 基态原子2p能级上各轨道中均有电子且电子的自旋方向相同 | 基态原子的核外电子共有17种运动状态 | 位于第四周期第VA族 |
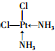 (YH3作为一个整体写)
(YH3作为一个整体写)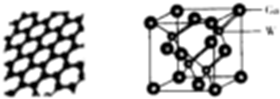
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸和氢氧化钡溶液反应 | B. | 稀硝酸与氢氧化钠溶液反应 | ||
| C. | 醋酸与氢氧化钾溶液反应 | D. | 盐酸与氢氧化铁反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com