
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
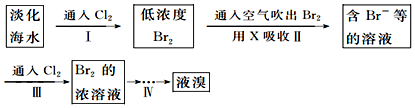
分析 (1)A、亚硫酸根离子可以和氧化性的溴单质间发生氧化还原反应;
B、氯气具有氧化性,可已将溴离子氧化为溴单质;
C、根据氧化还原反应的方程式计算即可,标准状况每获得1molBr2,需要消耗标况下Cl222.4L;
D、溴单质在有机溶剂溶解度大,可以利用有机溶剂萃取溴单质,得到萃取液通过蒸馏得到纯溴;
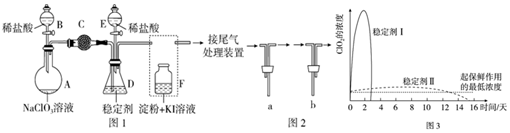
(2)A.为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢;
B.F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,说明Cl2被吸收;
C.在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
D.由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度;
(3)由于次氯酸的酸性介于碳酸的两级电离常数之间,因此84消毒液露置在空气中与二氧化碳反应只能生成碳酸氢钠;
(4)继续滴加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸.
解答 解:(1)A、亚硫酸根离子可以和氧化性的溴单质间发生氧化还原反应,可以用所给物质来吸收溴单质,故A正确;
B、氯气具有氧化性,可以将溴离子氧化为溴单质,即2Br-+Cl2═2Cl-+Br2,故B正确;
C、发生2Br-+Cl2═2Cl-+Br2,每获得1molBr2,需要消耗标况下Cl222.4L,故C错误;
D、从溴水中提取溴可以采用萃取、分液和蒸馏的方法,故D正确.
故答案为:C;
(2)A.为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,故A正确;
B.F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2,故B正确;
C.在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,故C正确;
D.由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,故D错误;
故答案为:D;
(3)由于次氯酸的酸性介于碳酸的两级电离常数之间,因此84消毒液露置在空气中与二氧化碳反应只能生成碳酸氢钠,
方程式为NaClO+CO2+H2O═HClO+NaHCO3,生成的HClO不稳定,见光分解:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,ClO-与Cl-在酸性条件下发生氧化还原反应生成,离子方程式为ClO-+Cl-+2H+═Cl2↑+H2O,
故答案为:NaClO+CO2+H2O═HClO+NaHCO3;2HClO$\frac{\underline{\;关照\;}}{\;}$2HCl+O2↑;ClO-+Cl-+2H+═Cl2↑+H2O;
(4)继续滴加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸,方程式为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2、I2、6H2O、2、10HCl.
点评 本题考查了海水中提取溴的流程、以ClO2的制备、吸收、释放为载体,考查实验制备方案设计、基本操作、对装置及操作的分析评价、物质分离和提纯的方法等,注意根据问题进行制备流程分析,题目难度中等


科目:高中化学 来源: 题型:解答题
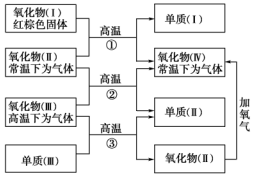 以下一些氧化物和单质之间可发生如图所示的反应:
以下一些氧化物和单质之间可发生如图所示的反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,加热生成Li2O2 | |
| B. | 16O2与18O2互为同分异构体 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | HF、HCl、HBr、HI的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 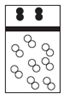 | C. | 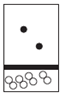 | D. | 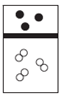 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
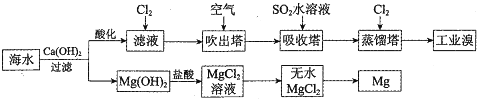
 _.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应
_.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com