
| A. | 长期放置的漂白粉是因与空气中的氧气发生反应而变质 | |
| B. | 粗硅提纯是利用H2作还原剂,将硅从其氯化物中还原出来 | |
| C. | 利用半透膜除去海水中的NaCl、MgCl2等离子化合物可获得淡水 | |
| D. | 工业上用铝热反应来冶炼Fe、Cr、Mn、V等稀有金属 |
分析 A.漂白粉与空气中的水、二氧化碳发生反应生成碳酸钙和HClO;
B.氢气具有还原性,还原四氯化硅生成Si;
C.半透膜不能除去离子;
D.Fe不是稀有金属.
解答 解:A.漂白粉与空气中的水、二氧化碳发生反应生成碳酸钙和HClO,不发生氧化还原反应,故A错误;
B.氢气具有还原性,还原四氯化硅生成Si,粗硅提纯是利用H2作还原剂,故B正确;
C.半透膜不能除去离子,可利用蒸发、离子交换膜法等得到淡水,故C错误;
D.Fe不是稀有金属,工业上用铝热反应来冶炼Fe、Cr、Mn、V等金属,故D错误;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握发生的反应、海水资源应用、铝热反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
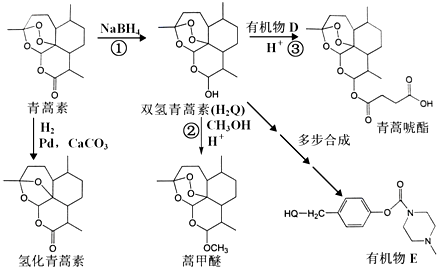
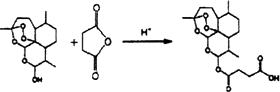 .
.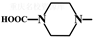 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 方案可行.能准确测定溶液中的c(I2) | |
| B. | 方案可行,可采用淀粉做该滴定反应的指示剂 | |
| C. | 不可行.只能测得溶液中c(I2)与c(I3-)之和 | |
| D. | 不可行.因为I-能与Na2S2O3发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
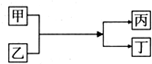
| A. | 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 | |
| B. | 若甲为水,丁为氢氧化钠,则丙一定是氢气 | |
| C. | 若甲为铝,丁为铁,则乙一定是氧化铁 | |
| D. | 若甲为镁,丁为氢气.则乙一定是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰火的五彩缤纷是某些金属元素化学性质的体现 | |
| B. | 高纯度的单晶硅用于制造登月车的光电池和光导纤维 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 用明矾可以将自来水净化成纯净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数为 NA | |
| B. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| C. | 将等物质的量的SO3和SO2溶于水,所得溶液中H+数目相等 | |
| D. | 常温常压下,1.06g Na2CO3溶于水形成的溶液中含有Na+离子数为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com