
电子表所用纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液。其电极反应是:
Zn+2OH-—→ZnO+H2O+2e-
Ag2O+H2O+2e-—→2Ag+2OH-
总反应式为:Ag2O+Zn===2Ag+ZnO
下列判断正确的是( )
①锌为正极,Ag2O为负极
②锌为负极,Ag2O为正极
③原电池工作时,负极区溶液pH减小
④原电池工作时,负极区溶液pH增大
A.①② B.①③ C.②③ D.①④
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
密闭容器中发生可逆反应: X2(g)+Y2(g)  2Z(g)。已知起始时X2、Y2、Z各物质的浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,反应在一定条件下达平衡时,各物质的浓度可能是()
2Z(g)。已知起始时X2、Y2、Z各物质的浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,反应在一定条件下达平衡时,各物质的浓度可能是()
A. c(Z)=0.3mol·L-1
B. c(Y2)=0.35mol·L-1
C. c(Y2)=0.2mol·L-1
D. c(Z)=0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:
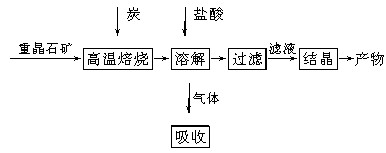
某研究小组在实验室用重晶石(主要成分为BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s)+4C(s)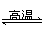
 4CO(g)+BaS(s)
4CO(g)+BaS(s)
ΔH1=571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)
 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)
ΔH2=226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,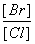 =__________________。
=__________________。
[Ksp(AgBr)=5.4×10-13 mol2·L-2,Ksp(AgCl)=2.0×10-10 mol2·L-2]
(3)反应:C(s)+CO2(g)
 2CO(g)的ΔH=________kJ·mol-1。
2CO(g)的ΔH=________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
________________________________________________________________________,
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO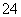 离子浓度逐渐增大
离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1的稀H2SO4中,乙同学将电极放入6
mol·L-1的NaOH溶液中,如图所示。
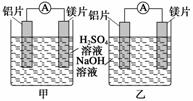
(1)写出甲池中发生的有关电极反应的反应式:
负极_______________________________________________________________,
正极_______________________________________________________________。
(2)写出乙池中发生的有关电极反应的反应式:
负极________________________________________________________________,
正极________________________________________________________________。
总反应离子方程式为__________________________________________________。
(3)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些结论?________。
A.利用原电池反应判断金属活动性顺序应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应条件多变,应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中加入0.2 mol·L-1 CH3COOH溶液,所加入溶液
的体积(V)和混合液中pH变化关系的曲线如下图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
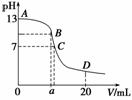
A.在B点有:c(Na+)=c(CH3COO-)
B.对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
仅用下表提供的仪器(夹持仪器和试剂任选),不能实现相应实验目的的是( )
| 选项 | 实验目的 | 仪器 |
| A | 除去氢氧化铝胶体中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
| B | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
| C | 用0.10 mol·L-1的盐酸滴定未知浓度的NaOH溶液的浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
| D | 用MnO2和浓盐酸制取干燥、纯净的Cl2 | 圆底烧瓶、分液漏斗、洗气瓶、集气瓶、导管、石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为:
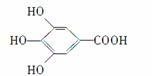
(1)用没食子酸制造墨水主要利用了________类化合物的性质(填代号)。
A.醇 B.酚 C.油脂 D.羧酸
(2)没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为______________。
(3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为__________________,其苯环只与-OH和-COOR两类取代基直接相连的同分异构体有______种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com