
【题目】消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
Ⅰ.含氯消毒剂在生产生活中有极其重要的作用。
(1)Cl2常用于自来水的杀菌消毒。Cl2溶于水后,溶液中具有氧化作用的含氯微粒除Cl2外还有______________。
(2)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质。其原因:一是_________________________________ (用离子方程式和相应的文字解释),二是生成的Fe(OH)3胶体具有较强的吸附 性能,可吸附水中的悬浮杂质,并能形成沉淀,使水净化。
(3)KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。常用作消毒剂,其变化可以表示为:2KClO3+4HCl(浓) = 2KCl+2ClO2↑+Cl2↑+2H2O,若改变温度至70 ℃,发现KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:_______________________。
Ⅱ.铁的化合物高铁酸钠(Na2FeO4)是一种新型净水剂。
(1)高铁酸钠主要通过反应制取:2Fe(OH)3+3X+ 4NaOH=2Na2FeO4+3NaCl+ 5H2O,则X的化学式为_____________。
(2)高铁酸钠在水中可以发生反应:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-↑+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性。
4Fe(OH)3+8OH-↑+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性。
Ⅲ.(1)H2O2可作为矿业废液消毒剂,有“绿色氧化剂”的美称。H2O2被称为“绿色氧化剂”的理由是________________________________。
(2)取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①加适量H2O2,紫红色褪去,并有气泡产生;
②加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③后通入足量SO2,发生反应:5SO2+2MnO4-+5Pb2++2H2O==5PbSO4↓+2Mn2++4H+。
则KMnO4、H2O2、PbO2氧化性由强到弱的顺序为_______________________。
【答案】HClO和ClO- Cl2+2Fe2+===2Cl-+2Fe3+ 能消耗多余的Cl2 5KClO3+6HCl(浓) === 5KCl+6ClO2↑+3H2O NaClO 氧化性 H2O2是氧化剂时其还原产物是H2O,没有污染 PbO2>KMnO4>H2O2
【解析】
Ⅰ.(1)根据Cl2溶解在水里和与水反应的产物性质进行解答;
(2)从反应要消耗Cl2及Cl2的毒性来分析解答;
(3)由题意写出参加氧化还原反应的物质,再由原子守恒写出其他化学式并配平方程式;
Ⅱ.(1)根据原子守恒来解答;
(2)由已知反应考虑高铁酸钠的化学性质;
Ⅲ.(1)由双氧水发生还原反应后的生成物来考虑;
(2)根据氧化还原反应里氧化剂、氧化产物的氧化性强弱规律进行解答。
Ⅰ.(1)Cl2与水反应:Cl2+H2O=HCl+HClO,生成的HClO是一种弱酸,能电离出少部分ClO-,HClO 、ClO-都具有强氧化性。
答案为:HClO和ClO-;
(2)Cl2有毒性,可以用来消毒,但残留在水中会影响水质,利用Cl2和FeSO4·7H2O发生反应;Cl2+2Fe2+===2Cl-+2Fe3+ 可以去除残留的Cl2。
答案为:Cl2+2Fe2+===2Cl-+2Fe3+ 能消耗多余的Cl2;
(3)KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,反应中KClO3中的Cl由+5价降为+4价,盐酸中的Cl由-1价升为+4价,再根据反应前后原子守恒确定其他生成物,最后配平,反应的化学方程式为;5KClO3+6HCl(浓) === 5KCl+6ClO2↑+3H2O。
答案为:5KClO3+6HCl(浓) === 5KCl+6ClO2↑+3H2O。
Ⅱ.(1)由反应2Fe(OH)3+3X+ 4NaOH=2Na2FeO4+3NaCl+ 5H2O前后各元素的原子个数不变可知X化学式为NaClO;
答案为:NaClO;
(2)4FeO42-+10H2O![]() 4Fe(OH)3+8OH-↑+3O2这个反应中FeO42-表现出很强的氧化性,而高铁酸钠能够消毒杀菌就是因为它的强氧化性;
4Fe(OH)3+8OH-↑+3O2这个反应中FeO42-表现出很强的氧化性,而高铁酸钠能够消毒杀菌就是因为它的强氧化性;
答案为:氧化性;
Ⅲ.(1)双氧水H2O2作氧化剂发生还原反应,得到的还原产物是H2O,对环境没有污染,被称为“绿色氧化剂”;
答案为:H2O2是氧化剂时其还原产物是H2O,没有污染;
(2)实验①说明H2O2能被KMnO4氧化,所以氧化性:KMnO4> H2O2,实验②说明Mn2+能与PbO2反应生成KMnO4,得出氧化性:PbO2>KMnO4,则KMnO4、H2O2、PbO2氧化性由强到弱的顺序为PbO2>KMnO4>H2O2;
答案为:PbO2>KMnO4>H2O2;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在银锌原电池中,以硫酸铜为电解质溶液,锌为_____极,电极上发生的是_____反应(“氧化”或“还原”).电极反应式为_____,锌片上观察到的现象为_____银为_____极,电极上发生的是_____反应(“氧化”或“还原”),电极反应式是_____,银片上观察到的现象是_____.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾(CuSO45H2O)高温时发生反应:2CuSO45H2O![]() 2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( )
2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( )
A.可用于胆矾分解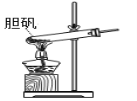
B.可用于检验产物是否含H2O 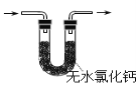
C.可用于收集O2 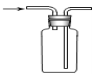
D.可用于吸收胆矾分解的SO2 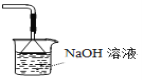
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W原子序数依次增大,其中Y是构成物质种类最多的一种元素。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙是其中三种元素对应的单质,m的自述是“诞生在闪电的弧光中,强大的能量造就了我”。n能使湿润的红色石蕊试纸变蓝。上述物质的转化关系如图所示(反应条件已略去)。下列说法正确的是

A. 常温常压下,X与Y组成的化合物一定为气体
B. X、Z、W三种元素不能组成离子化合物
C. 原子半径:X<W<Y<Z
D. 图示转化关系中涉及的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 实验目的 | 分离方法 | 原理 |
A | 除去CO2中的HCl | 通入饱和Na2CO3溶液 | HCl和Na2CO3溶液反应生成CO2 |
B | 除去乙醇中少量的乙酸 | 加入足量生石灰蒸馏 | 乙醇和乙酸钙的沸点相差较大 |
C | 除去KNO3固体中NaCl | 冷却热饱和溶液重结晶 | NaCl在水中的溶解度很大 |
D | 分离乙酸乙酯和乙醇 | 用分液漏斗分液 | 乙醇乙酯和乙醇的密度不同 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:

已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O![]() ===S4O
===S4O![]() +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用废旧镀锌铁皮按下列流程制备七水硫酸锌(ZnSO4·7H2O)

相关信息如下:
①金属离子形成氢氧化物沉淀的pH,如图A所示。
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线如图B所示。

请回答:
(1)为提高镀锌铁皮中金属离子的浸出率,除了可适当增加硫酸的浓度,还可以采取的措施有:_______(任写一条)。
(2)步骤Ⅱ中需加入过量H2O2,请用离子方程式表示H2O2的作用________。
(3)步骤Ⅲ中调节pH范围为_______,调节pH宜选用的试剂为_______。
A.稀硫酸 B.氢氧化锌 C.氢氧化钠 D.氧化锌
(4)检验步骤Ⅲ所得滤液中是否含有Fe3+可采用的实验方法是_______。
(5)步骤Ⅳ需要用到下列所有操作:a.蒸发至溶液出现晶膜 b.在60℃蒸发溶剂 c.冷却至室温 d.在100℃蒸发溶剂 e.过滤
请给出上述操作的正确顺序______(操作可敢复使用)。
(6)步骤V中,某同学采用不同降温方式进行冷却结都,测得ZnSO4·7H2O颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均的较大晶粒,宜选择______方式进行冷却结晶。
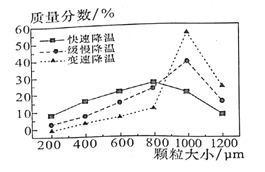
A.快速降温 B.级慢降温 C.变速降温
(7)ZnSO4可用于制备金属锌。用锌和高铁酸钾制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电池的总反应是2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。该电池正极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:

称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
(1)装置c的作用是____________________________。
(2)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(3)滴定时,标准碘溶液所耗体积为_____mL;用化学方程式表示滴定的原理:________________________________________。
(4)计算该黄铜矿的纯度___________________。
(5)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为_________;证明炉渣中含有FeO的实验现象为:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com