
分析 (1)氯元素化合价变化的做还原剂,氯元素化合价不变的做酸,浓盐酸在此反应中显示出来的性质是还原性和酸性;
(2)氯气易溶于水,在饱和氯化钠溶液中溶解度较小;
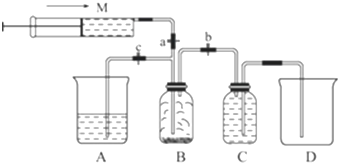
(3)由题意可知用仪器A吸收过量的氯气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)若用含1.6mol氯化氢的浓盐酸与足量的高锰酸钾反应,2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,在标准状况下收集到的氯气体积应为0.5mol,标准状况体积为22.4L/mol×0.5mol=11.2L,但足量高锰酸钾反应,随反应进行,浓盐酸浓度减小,变为稀盐酸后不能继续生成氯气.
解答 解:(1)反应的化学方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,氯元素化合价变化的做还原剂,氯元素化合价不变的做酸,浓盐酸在此反应中显示出来的性质是还原性和酸性,
故答案为:B;
(2)氯气易溶于水,在饱和氯化钠溶液中溶解度较小,所以可以用排饱和食盐水的方法收集氯气,装置C中为饱和食盐水,
故答案为:饱和NaCl溶液;
(3)由题意可知用仪器A吸收过量的氯气,要想使反应剩余气体进入A,应关闭弹簧夹a和弹簧夹b,打开弹簧夹c,氯气与氢氧化钠溶液反应的化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O,反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O,
故答案为:b,c;2OH-+Cl2═Cl-+ClO-+H2O;
(4)若用含1.6mol氯化氢的浓盐酸与足量的高锰酸钾反应,2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,在标准状况下收集到的氯气体积应为0.5mol,标准状况体积为22.4L/mol×0.5mol=11.2L,但足量高锰酸钾反应,随反应进行,浓盐酸浓度减小,变为稀盐酸后不能继续生成氯气,所以在标准状况下收集到的氯气体积<11.2L,
故答案为:C.
点评 本题考查了氯气的制法和有关氧化还原的计算,题目难度中等,熟悉物质的性质和制备原理,明确氧化还原反应的规律是解题关键,注意反应中盐酸既表现还原性又表现酸性.


科目:高中化学 来源: 题型:选择题
| A. | 碘酸钾 | B. | 碘化钾 | C. | 碘单质 | D. | 络合碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碰撞理论认为,反应物分子间必须相互碰撞才有可能发生反应,反应速率的大小与单位时间内反应物分子间有效碰撞的次数成正比 | |
| B. | 电解原理在生产中有着广泛的应用,工业上用电解熔融的氯化钠、氯化镁、氯化铝来冶炼Na、Mg、Al等活泼金属单质 | |
| C. | 盖斯定律表明,一个化学反应的焓变(△H)不仅与反应的起始和最终状态有关,还与反应的途径及过程有关 | |
| D. | 在工业生产中,研制出性能优良的催化剂可以使反应的温度降低,有效提高反应物的转化率,从而起到很好的节能效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 合金质量(mg) | NO体积(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
| A. | 硝酸的浓度为4.0mol•L-1 | B. | 硝酸的浓度为1.0mol•L-1 | ||
| C. | 至少需要NaOH溶液的体积为75mL | D. | 至少需要NaOH溶液的体积为85mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com