
SNCR£SCRŹĒŅ»ÖÖŠĀŠĶµÄŃĢĘųĶŃĻõ¼¼Źõ(³żČ„ŃĢĘųÖŠµÄNOx£©£¬ĘäĮ÷³ĢČēĻĀ£ŗ 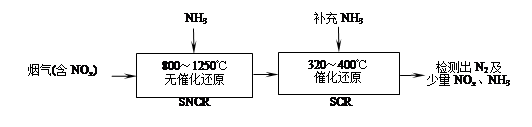
£Ø1£©·“Ó¦2NO£«2CO 2CO2£«N2Äܹ»×Ō·¢½ųŠŠ£¬ŌņøĆ·“Ó¦µÄ¦¤H 0£ØĢī”°£¾”±»ņ”°£¼”±£©”£
2CO2£«N2Äܹ»×Ō·¢½ųŠŠ£¬ŌņøĆ·“Ó¦µÄ¦¤H 0£ØĢī”°£¾”±»ņ”°£¼”±£©”£
£Ø2£©SNCR£SCRĮ÷³ĢÖŠ·¢ÉśµÄÖ÷ŅŖ·“Ó¦ÓŠ£ŗ
¢Ł4NO(g)£«4NH3(g)£«O2(g) 4N2(g)£«6H2O(g) ¦¤H£½£1627.2kJ?mol£1£»
4N2(g)£«6H2O(g) ¦¤H£½£1627.2kJ?mol£1£»
¢Ś6NO(g)£«4NH3(g) 5N2(g)£«6H2O(g) ¦¤H£½£1807.0 kJ?mol£1£»
5N2(g)£«6H2O(g) ¦¤H£½£1807.0 kJ?mol£1£»
¢Ū6NO2(g)£«8NH3(g) 7N2(g)£«12H2O(g) ¦¤H£½£2659.9 kJ?mol£1£»
7N2(g)£«12H2O(g) ¦¤H£½£2659.9 kJ?mol£1£»
·“Ó¦N2(g)£«O2(g) 2NO(g)µÄ¦¤H£½ kJ?mol£1”£
2NO(g)µÄ¦¤H£½ kJ?mol£1”£
£Ø3£©NO2”¢O2ŗĶČŪČŚNaNO3æÉÖĘ×÷Č¼ĮĻµē³Ų£¬ĘäŌĄķ¼ūĶ¼”£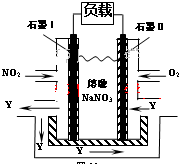
øƵē³ŲŌŚŹ¹ÓĆ¹ż³ĢÖŠŹÆÄ«Iµē¼«ÉĻÉś³ÉŃõ»ÆĪļY£¬Ęäµē¼«·“Ó¦ĪŖ£ŗ
£Ø4£©æÉĄūÓĆøƵē³Ų“¦Ąķ¹¤Ņµ·ĻĖ®ÖŠŗ¬ÓŠµÄCr2O72££¬“¦Ąķ¹ż³ĢÖŠÓĆFe×÷Į½¼«µē½āŗ¬Cr2O72-µÄĖįŠŌ·ĻĖ®£¬Ėę×ŵē½āµÄ½ųŠŠ£¬Ņõ¼«ø½½üČÜŅŗpHÉżøߣ¬²śÉśCr£ØOH£©3³ĮµķĄ“³żČ„Cr2O72-”£
¢ŁŠ“³öµē½ā¹ż³ĢÖŠCr2O72£±»»¹ŌĪŖCr3+µÄĄė×Ó·½³ĢŹ½£ŗ ”£
¢ŚøƵē³Ų¹¤×÷Ź±Ć擦Ąķ100L Cr2O72-ÅضČĪŖ0.002mol/L·ĻĖ®£¬Ļūŗıź×¼×“æöĻĀŃõĘų L”£
£Ø1£©< (2·Ö)£Ø2£©+179.8 (2·Ö) £Ø3£©NO2£«NO3££e££½N2O5(2·Ö)
£Ø4£©¢ŁCr2O72£+ 6Fe2++ 14H+= 2Cr3++ 6Fe3++7 H2O (2·Ö)¢Ś13.44 (2·Ö)
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©ŅŖĻė·“Ó¦2NO£«2CO 2CO2£«N2Äܹ»×Ō·¢½ųŠŠ£¬ŌņÓŠ¦¤H”ŖT¦¤S£¼0£¬øĆ·“Ó¦ĪŖĘųĢåĪļÖŹµÄĮæ¼õŠ”µÄģŲ¼õ·“Ó¦£¬¦¤S£¼0£¬ŌņøĆ·“Ó¦µÄ¦¤H£¼0£»£Ø2£©øł¾ŻøĒĖ¹¶ØĀÉ£ŗ¢Ł”Ŗ¢ŚµĆ
2CO2£«N2Äܹ»×Ō·¢½ųŠŠ£¬ŌņÓŠ¦¤H”ŖT¦¤S£¼0£¬øĆ·“Ó¦ĪŖĘųĢåĪļÖŹµÄĮæ¼õŠ”µÄģŲ¼õ·“Ó¦£¬¦¤S£¼0£¬ŌņøĆ·“Ó¦µÄ¦¤H£¼0£»£Ø2£©øł¾ŻøĒĖ¹¶ØĀÉ£ŗ¢Ł”Ŗ¢ŚµĆ
N2(g)£«O2(g) 2NO(g)µÄ¦¤H£½+179.8kJ?mol£1£»£Ø3£©ÓÉĢāøųČ¼ĮĻµē³Ų×°ÖĆĶ¼ÖŖ£¬NO2ŌŚøŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬Éś³ÉN2O5,µē¼«·“Ó¦Ź½ĪŖ£ŗNO2£«NO3££e££½N2O5£»£Ø4£©¢ŁÓĆFe×÷Į½¼«µē½āŗ¬Cr2O72-µÄĖįŠŌ·ĻĖ®£¬Ńō¼«µē¼«·“Ó¦Ź½ĪŖ£ŗFe - 2e-=Fe2+£¬µē½ā¹ż³ĢÖŠCr2O72£±»»¹ŌĪŖCr3+µÄĄė×Ó·½³ĢŹ½ĪŖ
2NO(g)µÄ¦¤H£½+179.8kJ?mol£1£»£Ø3£©ÓÉĢāøųČ¼ĮĻµē³Ų×°ÖĆĶ¼ÖŖ£¬NO2ŌŚøŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬Éś³ÉN2O5,µē¼«·“Ó¦Ź½ĪŖ£ŗNO2£«NO3££e££½N2O5£»£Ø4£©¢ŁÓĆFe×÷Į½¼«µē½āŗ¬Cr2O72-µÄĖįŠŌ·ĻĖ®£¬Ńō¼«µē¼«·“Ó¦Ź½ĪŖ£ŗFe - 2e-=Fe2+£¬µē½ā¹ż³ĢÖŠCr2O72£±»»¹ŌĪŖCr3+µÄĄė×Ó·½³ĢŹ½ĪŖ
Cr2O72£+ 6Fe2++ 14H+= 2Cr3++ 6Fe3++7 H2O£»¢Śøł¾ŻĢāøų·“Ó¦ŗĶµē×ÓŹŲŗćµĆCr2O72£ŗĶŃõĘųµÄ¹ŲĻµŹ½£ŗCr2O72£”Ŗ”Ŗ3O2£»100L Cr2O72-ÅضČĪŖ0.002mol/L·ĻĖ®ÖŠCr2O72-µÄĪļÖŹµÄĮæĪŖ0.2mol£¬ĻūŗÄŃõĘųĪŖ0.6mol£¬±ź×¼×“æöĻĀµÄĢå»żĪŖ13.44L”£
æ¼µć£ŗŅŌ»Æѧ¹¤ŅÕĪŖŌŲĢåæ¼²é»Æѧ·“Ó¦·½ĻņµÄÅŠ¶Ļ”¢øĒĖ¹¶ØĀÉ”¢µē»Æѧ¼°Ļą¹Ų¼ĘĖć”£


 “ŗÓź½ĢÓżĶ¬²½×÷ĪÄĻµĮŠ“š°ø
“ŗÓź½ĢÓżĶ¬²½×÷ĪÄĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
µŖŹĒµŲĒņÉĻŗ¬Įæ·įø»µÄ”ŖÖÖŌŖĖŲ£¬µŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ£¬
¼õÉŁN µÄŃõ»ÆĪļŌŚ“óĘųÖŠµÄÅÅ·ÅŹĒ»·¾³±£»¤µÄÖŲŅŖÄŚČŻÖ®Ņ»”£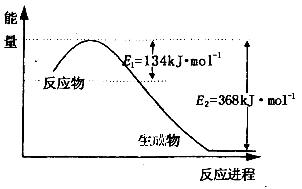
(1)ÉĻĶ¼ŹĒ1molNO2ŗĶ1mol CO·“Ӧɜ³ÉCO2ŗĶNO¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬ĒėŠ“³öNO2ŗĶCO·“Ó¦µÄČČ»Æѧ·½³ĢŹ½________________________________________£»
ÓÖÖŖ£ŗN2(g)+ O2(g)£½2NO(g) ”÷H£½£«180kJ/mol£»2NO(g)+O2(g)£½2NO2(g) ”÷H£½£112.3kJ/mol£¬Ōņ·“Ó¦2NO(g)+2CO(g) N2(g)+ 2CO2(g)µÄ”÷H£½_______________£»
N2(g)+ 2CO2(g)µÄ”÷H£½_______________£»
(2)Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠNO2ŗĶO2æÉ·¢ÉśĻĀĮŠ·“Ó¦£ŗ4NO2(g) + O2(g) 2N2O5(g)”£ŅŃÖŖĢåĻµÖŠn(NO2)Ėꏱ¼ä±ä»Æ¼ÓĻĀ±ķ£ŗ
2N2O5(g)”£ŅŃÖŖĢåĻµÖŠn(NO2)Ėꏱ¼ä±ä»Æ¼ÓĻĀ±ķ£ŗ
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŃŠ¾æ¶žŃõ»ÆĮņ”¢µŖŃõ»ÆĪļ”¢PM2.5µČ“óĘųĪŪČ¾ĪļµÄÖĪĄķ¾ßÓŠÖŲŅŖŅāŅ唣
£Ø1£©¶ŌPM2.5Ńł±¾ÓĆÕōĮóĖ®“¦ĄķÖĘ³É“ż²āŹŌŃł”£Čō²āµĆøĆŹŌŃłÖŠ³żH+ŗĶOH©ĶāĘäĖüĖ®ČÜŠŌĄė×ӵĻÆѧ×é·Ö¼°ĘäĘ½¾łÅضČČēĻĀ±ķ£ŗ
| Ąė×Ó | K+ | Na+ | NH4+ | SO42- | NO3© | Cl© |
| ÅضČ/mol”¤L-1 | 4”Į10-6 | 6”Į10-6 | 2”Į10-5 | 4”Į10-5 | 3”Į10-5 | 2”Į10-5 |
 2NO(g£©
2NO(g£©  H£¾0
H£¾0²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø¢ń£©¼×“¼ŹĒŅ»ÖÖŠĀŠĶµÄĘū³µ¶ÆĮ¦Č¼ĮĻ£¬¹¤ŅµÉĻæÉĶعżCOŗĶH2»ÆŗĻÖʱø¼×“¼£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗCO(g)+2H2(g) CH3OH(g) ”÷H
CH3OH(g) ”÷H
ŅŃÖŖijŠ©»Æѧ¼üµÄ¼üÄÜŹż¾ŻČēĻĀ±ķ£ŗ
| »Æѧ¼ü | C”ŖC | C”ŖH | H”ŖH | C”ŖO | C”ŌO | H”ŖO |
| ¼üÄÜ/kJ”¤mol£1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| ·“Ó¦Ź±¼ä/min | 0 | 5 | 10 | 15 | 20 | 25 |
| Ń¹Ēæ/MPa | 12£®6 | 10£®8 | 9£®5 | 8£®7 | 8£®4 | 8£®4 |
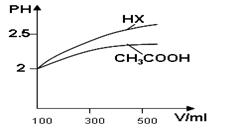
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
100”ꏱ£¬ŌŚ1LŗćĪĀŗćČŻµÄĆܱÕČŻĘ÷ÖŠ£¬ĶØČė0.1 mol N2O4£¬·¢Éś·“Ó¦£ŗN2O4(g)  2NO2(g);”÷H=" +57.0" kJ”¤mol-1£¬NO2ŗĶN2O4µÄÅضČČēĶ¼¼×ĖłŹ¾”£NO2ŗĶN2O4µÄĻūŗÄĖŁĀŹÓėĘäÅØ¶ČµÄ¹ŲĻµČēŅŅĶ¼ĖłŹ¾£¬
2NO2(g);”÷H=" +57.0" kJ”¤mol-1£¬NO2ŗĶN2O4µÄÅضČČēĶ¼¼×ĖłŹ¾”£NO2ŗĶN2O4µÄĻūŗÄĖŁĀŹÓėĘäÅØ¶ČµÄ¹ŲĻµČēŅŅĶ¼ĖłŹ¾£¬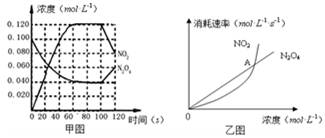
£Ø1£©ŌŚ0”«60sÄŚ£¬ŅŌN2O4±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ mol”¤L-1”¤s-1”£
£Ø2£©øł¾Ż¼×Ķ¼ÖŠÓŠ¹ŲŹż¾Ż£¬¼ĘĖć100”ꏱøĆ·“Ó¦µÄĘ½ŗā³£ŹżK1= =0.36mol.L-1.S-1
ČōĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶ČÖĮ120”ę£¬“ļµ½ŠĀĘ½ŗāµÄ³£ŹżŹĒk2£¬Ōņk1 k2£ØĢī”°£¾”±”¢”°£¼”±»ņ”°£½”±£©”££Ø3£©·“Ó¦½ųŠŠµ½100sŹ±£¬ČōÓŠŅ»ĻīĢõ¼ž·¢Éś±ä»Æ£¬±ä»ÆµÄĢõ¼žæÉÄÜŹĒ ”£
A£®½µµĶĪĀ¶Č B£®ĶØČėŗ¤ĘųŹ¹ĘäŃ¹ĒæŌö“ó C£®ÓÖĶłČŻĘ÷ÖŠ³äČėN2O4 D£®Ōö¼ÓČŻĘ÷Ģå»ż
£Ø4£©ŅŅĶ¼ÖŠ, ½»µćA±ķŹ¾øĆ·“Ó¦µÄĖł“¦µÄדĢ¬ĪŖ ”£
A£®Ę½ŗāדĢ¬ B£®³ÆÕż·“Ó¦·½ĻņŅĘ¶Æ C£®³ÆÄę·“Ó¦·½ĻņŅĘ¶Æ D£®ĪŽ·ØÅŠ¶Ļ
£Ø5£©ŅŃÖŖN2(g)+2O2(g)=2NO2(g) ”÷H=" +67.2" kJ”¤mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ”÷H=" -534.7" kJ”¤mol-1
N2O4(g)  2NO2(g) ”÷H=" +57.0" kJ”¤mol-1
2NO2(g) ”÷H=" +57.0" kJ”¤mol-1
Ōņ2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ”÷H= kJ”¤mol-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŅŅ“¼ĘūÓĶŹĒŅ»ÖÖÓÉĮøŹ³¼°ø÷ÖÖÖ²ĪļĻĖĪ¬¼Ó¹¤³ÉµÄČ¼ĮĻŅŅ“¼ŗĶĘÕĶØĘūÓĶ°“Ņ»¶Ø±ČĄż»ģÅäŠĪ³ÉµÄŠĀŠĶĢę“śÄÜŌ“”£°“ÕÕĪŅ¹śµÄ¹ś¼Ņ±ź×¼£¬ŅŅ“¼ĘūÓĶŹĒÓĆ90%µÄĘÕĶØĘūÓĶÓė10%µÄŅŅ“¼µ÷ŗĶ¶ų³É”£
£Ø1£©ÓÉĮøŹ³»ņø÷ÖÖÖ²ĪļĻĖĪ¬æɵƵ½ĘĻĢŃĢĒ£¬Š“³öĘĻĢŃĢĒÖʵĆŅŅ“¼µÄ»Æѧ·½³ĢŹ½: ”£
£Ø2£©ŌŚ³£ĪĀ³£Ń¹ĻĀ£¬1gC2H5OHĶźČ«Č¼ÉÕÉś³ÉCO2ŗĶŅŗĢ¬H2OŹ±·Å³ö29.71 kJČČĮ棬±ķŹ¾øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø3£©ĻĀĶ¼ŹĒŅ»øöŅŅ“¼Č¼ĮĻµē³Ų¹¤×÷Ź±µÄŹ¾ŅāĶ¼£¬ŅŅ³ŲÖŠµÄĮ½øöµē¼«Ņ»øöŹĒŹÆÄ«µē¼«£¬Ņ»øöŹĒĢśµē¼«£¬¹¤×÷Ź±M”¢NĮ½øöµē¼«µÄÖŹĮ涼²»¼õÉŁ£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ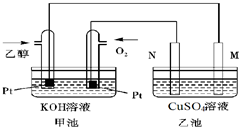
¢Ł¼ÓČėŅŅ“¼µÄPtµē¼«µÄµē¼«·“Ó¦Ź½ĪŖ_________________________”£
¢ŚŌŚ¹¤×÷¹ż³ĢÖŠ£¬ŅŅ³ŲÖŠĮ½µē¼«¾łŹÕ¼Æµ½±ź×¼×“æöĻĀ224mLĘųĢåŹ±£¬¼×³ŲÖŠĄķĀŪÉĻĻūŗÄŃõĘųµÄĢå»żĪŖ mL(±ź×¼×“æöĻĀ)£»Čō“ĖŹ±ŅŅ³ŲČÜŅŗĢå»żĪŖ200mL£¬ŌņŅŅ³ŲÖŠČÜŅŗµÄpHĪŖ ”£
¢ŪČōŅŖŹ¹¢ŚÖŠŅŅ³ŲµÄČÜŅŗĶźČ«»Öø“µ½ĘšŹ¼×“Ģ¬£¬æÉĻņŅŅ³ŲÖŠ¼ÓČė (Ģī“śŗÅ)
| A£®0.01molCu |
| B£®0.01molCuO |
| C£®0.01molCu(OH)2 |
| D£®0.01molCuCO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
(14·Ö) ÄÜŌ“¶ĢȱŹĒČĖĄąÉē»įĆęĮŁµÄÖŲ“óĪŹĢā”£¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠ¹ć·ŗµÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°”£
£Ø1£©¹¤ŅµÉĻŅ»°ć²ÉÓĆĻĀĮŠĮ½ÖÖ·“Ó¦ŗĻ³É¼×“¼£ŗ
·“Ó¦I£ŗ CO(g) £« 2H2(g)  CH3OH(g)
CH3OH(g)
·“Ó¦II£ŗ CO2(g) £« 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
ÉĻŹö·“Ó¦·ūŗĻ”°Ō×Ó¾¼Ć”±ŌŌņµÄŹĒ £ØĢī”°I”±»ņ”°¢ņ”±£©”£
£Ø2£©ŅŃÖŖŌŚ³£ĪĀ³£Ń¹ĻĀ£ŗ
¢Ł 2CH3OH(l) £« 3O2(g) £½ 2CO2(g) £« 4H2O(g) ¦¤H £½£1275.6 kJ£Æmol
¢Ś 2CO (g)+ O2(g) £½ 2CO2(g) ¦¤H £½£566.0 kJ£Æmol
¢Ū H2O(g) £½ H2O(l) ¦¤H £½£44.0 kJ£Æmol
ŌņCH3OH(l)+ O2(g) £½ CO(g) + 2H2O(l) ¦¤H£½
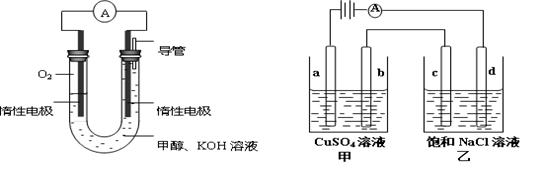
£Ø3£©Ä³ŹµŃ銔×éŅĄ¾Ż¼×“¼Č¼Éյķ“Ó¦ŌĄķ£¬Éč¼ĘČēĻĀ×óĶ¼ĖłŹ¾µÄµē³Ų×°ÖĆ”£
¢Ł øƵē³Ųøŗ¼«µÄµē¼«·“Ó¦ĪŖ ”£
¢Ś ¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬲āµĆČÜŅŗµÄpH £ØĢīŌö“󔢲»±ä”¢¼õŠ”£©”£
¢ŪÓĆøƵē³Ų×÷µēŌ“£¬×é³ÉČēĻĀÓŅĶ¼ĖłŹ¾×°ÖĆ(a”¢b”¢c”¢d¾łĪŖŹÆÄ«µē¼«)£¬¼×ČŻĘ÷×°250mL0.04mol/LCuSO4ČÜŅŗ£¬ŅŅČŻĘ÷×°300mL±„ŗĶNaClČÜŅŗ£¬Š“³öcµē¼«µÄµē¼«·“Ó¦ £¬³£ĪĀĻĀ£¬µ±300mLŅŅČÜŅŗµÄpHĪŖ13Ź±£¬¶ĻæŖµēŌ“£¬ŌņŌŚ¼×“¼µē³ŲÖŠĻūŗÄO2µÄĢå»żĪŖ mL(±ź×¼×“æö) £¬µē½āŗóĻņ¼×ÖŠ¼ÓČėŹŹĮæĻĀĮŠÄ³Ņ»ÖÖĪļÖŹ£¬æÉŅŌŹ¹ČÜŅŗ»Öø“µ½ŌĄ“דĢ¬£¬øĆĪļÖŹŹĒ (ĢīŠ“±ąŗÅ) ”£
| A£®CuO | B£®CuCO3”””” | C£®Cu(OH)2 | D£®Cu2(OH)2CO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø1£©ŅŃÖŖ£ŗ¢ŁFe(s)+1£Æ2O2(g)=FeO(s) ”÷H1=-272.0KJ”¤mol-1
¢Ś2Al(s)+3£Æ2(g)=Al2O3(s) ”÷H2=-1675.7KJ”¤mol-1
AlŗĶFeO·¢ÉśĀĮČČ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ__ __”£
ijĶ¬Ń§ČĻĪŖ£¬ĀĮČČ·“Ó¦æÉÓĆÓŚ¹¤ŅµĮ¶Ģś£¬ÄćµÄÅŠ¶ĻŹĒ_ (Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±)£¬ÄćµÄĄķÓÉ 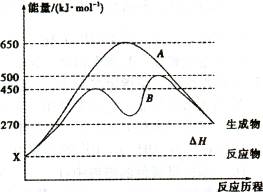
£Ø2£©·“Ó¦ĪļÓėÉś³ÉĪļ¾łĪŖĘųĢ¬µÄijæÉÄę·“Ó¦ŌŚ²»Ķ¬Ģõ¼žĻĀµÄ·“Ó¦Ąś³Ģ·Ö±šĪŖA£®B£¬ČēĶ¼ĖłŹ¾”£¢Ł¾ŻĶ¼ÅŠ¶ĻøĆ·“Ó¦ŹĒ (Ģī”°Īü”±»ņ”°·Å”± )ČČ·“Ó¦£¬µ±·“Ó¦“ļµ½Ę½ŗāŗó£¬ĘäĖūĢõ¼ž²»±ä£¬£¬ÉżøßĪĀ¶Č£¬·“Ó¦ĪļµÄ×Ŗ»ÆĀŹ½« (Ģī”°Ōö“ó”±”¢ ”°¼õŠ””±»ņ”°²»±ä”±)”£
¢ŚĘäÖŠBĄś³Ģ±ķĆ÷“Ė·“Ó¦²ÉÓƵÄĢõ¼žĪŖ
(Ģī×ÖÄø)”£
A.ÉżøßĪĀ¶Č B.Ōö“ó·“Ó¦ĪļµÄÅضČ
C.½µµĶĪĀ¶Č D.Ź¹ÓĆ“ß»Æ¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŅŃÖŖµ„ÖŹĮņŌŚĶس£Ģõ¼žĻĀŅŌS8(Š±·½Įņ)µÄŠĪŹ½“ęŌŚ£¬¶ųŌŚÕōĘųדĢ¬Ź±£¬ŗ¬ÓŠS2”¢S4”¢S6¼°S8µČ¶ąÖÖĶ¬ĖŲŅģŠĪĢ壬ĘäÖŠS4”¢S6ŗĶS8¾ßÓŠĻąĖĘµÄ½į¹¹ĢŲµć£¬Ęä½į¹¹ČēĻĀĶ¼ĖłŹ¾£ŗ
ŌŚŅ»¶ØĢõ¼žĻĀ£¬S8(s)ŗĶO2(g)·¢Éś·“Ó¦ŅĄ“Ī×Ŗ»ÆĪŖSO2(g)ŗĶSO3(g)”£·“Ó¦¹ż³ĢŗĶÄÜĮæ¹ŲĻµæÉÓĆĻĀĶ¼¼ņµ„±ķŹ¾(Ķ¼ÖŠµÄ¦¤H±ķŹ¾Éś³É1 molŗ¬Įņ²śĪļµÄŹż¾Ż)”£
(1)Š“³ö±ķŹ¾S8Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½_____________________”£
(2)Š“³öSO3·Ö½āÉś³ÉSO2ŗĶO2µÄČČ»Æѧ·½³ĢŹ½_________________________”£
(3)ČōŅŃÖŖSO2ÖŠĮņŃõ¼üµÄ¼üÄÜĪŖd kJ”¤mol-1£¬O2ÖŠŃõŃõ¼üµÄ¼üÄÜĪŖe kJ”¤mol-1£¬ŌņS8·Ö×ÓÖŠĮņĮņ¼üµÄ¼üÄÜĪŖ___________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com