
| A、(1)=(2)=(3) |
| B、(1)=(2)>(3) |
| C、(1)>(2)>(3) |
| D、(2)>(1)=(3) |
| 2.7g |
| 27g/mol |
| 2.7g |
| 27g/mol |
| 0.1mol |
| 2 |
| 0.1mol |
| 2 |
| 0.2mol |
| 6 |


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
 如图所示的原电池装置
如图所示的原电池装置查看答案和解析>>
科目:高中化学 来源: 题型:
 常温时,用1.0mol/L NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
常温时,用1.0mol/L NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )| A、1 mol/L 60mL |
| B、0.5 mol/L 80mL |
| C、0.5 mol/L40mL |
| D、1 mol/L 80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮气的转化率增大 |
| B、氢气的转化率不变 |
| C、氨气在平衡混合气体中的含量一定增大 |
| D、氨气在平衡混合气体中的物质的量增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用二氧化碳和环氧丙烷生产可降解高聚物有利于环境和生态 |
| B、高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
| C、光导纤维的主要成分不是二氧化硅而是单晶硅 |
| D、人体摄入油脂,在体内水解可得到高级脂肪酸和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有以下6种物质,结合相关问题填空:
有以下6种物质,结合相关问题填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
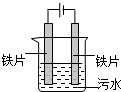 电浮选凝聚法处理污水的原理如图所示.电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体.下列说法正确的是( )
电浮选凝聚法处理污水的原理如图所示.电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体.下列说法正确的是( )| A、可以用铝片或铜片代替铁片 |
| B、阳极产生的气体可能是O2 |
| C、电解过程中H+向阳极移动 |
| D、若污水导电能力较弱,可加入足量硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com