
 非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.
非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.分析 L的焰色是黄色,则L中含有Na元素,金属单质M与氧气连续反应生成C,C与水反应生成D,而D与J反应得到L,则A为Na,非金属单质A与氧气连续反应生成I,I与水反应生成J,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀,则L含有硫酸根,故L为Na2SO4,由转化关系,可知B为Na2O、C为Na2O2、D为NaOH、M为S、N为SO2、I为SO3、J为H2SO4、K为Na2S.
解答 解:L的焰色是黄色,则L中含有Na元素,金属单质M与氧气连续反应生成C,C与水反应生成D,而D与J反应得到L,则A为Na,非金属单质A与氧气连续反应生成I,I与水反应生成J,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀,则L含有硫酸根,故L为Na2SO4,由转化关系,可知B为Na2O、C为Na2O2、D为NaOH、M为S、N为SO2、I为SO3、J为H2SO4、K为Na2S.
(1)K的化学式:Na2S,故答案为:Na2S;
(2)C与水反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)D与N反应的离子方程式:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O.
点评 本题考查无机物推断,涉及Na、S元素单质化合物性质,焰色反应及产生白色沉淀为推断突破口,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题

| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
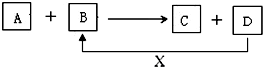 A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:
A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Na+、Cl-、SCN-、Fe3+ | |
| B. | 碱性溶液中:Na+、AlO2-、Cl-、SO42- | |
| C. | 加入铝粉后产生氢气的溶液中:Ba2+、K+、NO3-、Al3+ | |
| D. | 无色溶液中:Na+、HCO3-、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
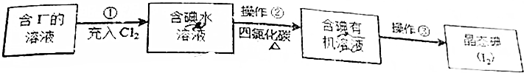
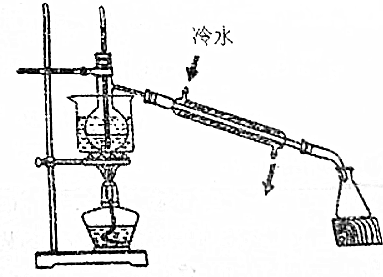
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,而氧化反应不能发生 | |
| D. | 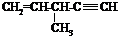 催化加氢可生成3-甲基己烷 催化加氢可生成3-甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠溶液 | B. | AgN03溶液 | C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 改变条件 | 平衡移动方向 | 导电能力 |
| A | 加入蒸馏水 | 逆向移动 | 减弱 |
| B | 加入少量冰醋酸 | 正向移动 | 增强 |
| C | 加入少量CH3COONa固体 | 正向移动 | 增强 |
| D | 加入少量0.1mol•L-1的稀硫酸 | 逆向移动 | 减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com