
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
解答 解:①所有的燃烧均属于放热反应; ②炸药爆炸属于放热反应; ③酸碱中和反应属于放热反应; ④二氧化碳通过炽热的碳反应生成CO,属于吸热反应; ⑤Ba(OH)2•8H2O与NH4Cl反应,属于吸热反应; ⑥金属与酸的反应属于放热反应,故铁粉与稀盐酸反应为放热反应; ⑦煅烧石灰石(主要成分是CaCO3)制生石灰(CaO),为高温分解反应,属于吸热反应; ⑧生石灰与水作用制熟石灰,属于放热反应; ⑨食物因氧化而腐败,属于缓慢氧化,是放热反应,
故答案为:①②③⑥⑧⑨;④⑤⑦.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:解答题
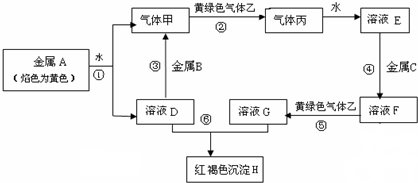
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯与浓硝酸、浓硫酸的混合物在60℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾可以检验CH2=CH-CHO中碳碳双键 | |
| C. | 将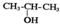 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| D. | 向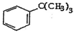 中通入足量的酸性高锰酸钾溶液可以得到 中通入足量的酸性高锰酸钾溶液可以得到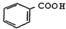 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c<b | B. | 氢化物的还原性:H2Y>HZ | ||
| C. | 原子半径:X<W | D. | 离子的氧化性:X+<W3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g)放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g)的△H<0 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 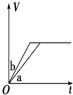 | C. | 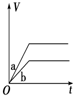 | D. | 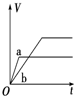 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的球棍模型示意图为: | B. | 乙烯的实验式为:CH2 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | 2-乙基-1,3-丁二烯分子的键线式: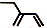 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
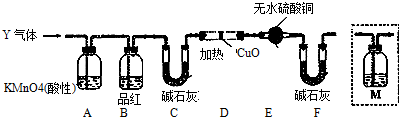
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com