
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O H2CO3
H2CO3
C.CO32-+H2O  HCO3-+OH-
HCO3-+OH-
D.HCO3-+H2O CO32- +H3O+
CO32- +H3O+
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:2014-2015学年广东省茂名市高三一模考试理综化学试卷(解析版) 题型:选择题
短周期元素X、T、Y、Z、R原子序数依次增大,T最内层电子数为最外层的2倍,部分元素的化合价关系如下表。则下列判断正确的是
X | Y | Z | R | |
主要化合价 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
A.非金属性:Z < R < Y
B.T与R可以形成化合物: TR2
C.X与R的单质均能使品红溶液褪色
D.T的最高价氧化物的水化物能与X、Y、Z的最高价氧化物反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:填空题
(15分)研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为 ;

(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是 ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是 。t1~t2时间内v正(乙) v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列解释物质用途的反应方程式不正确的是
A.用Fe2(SO4)3净水 Fe3+ +3H2O Fe(OH)3 +3H+
Fe(OH)3 +3H+
B.用Na2S处理含Hg2+废水 Hg2+ +S2-=HgS↓
C.用Na2CO3溶液处理水垢中的CaSO4 Ca2+ +CO32- =CaCO3↓
D.燃煤时加入石灰石,减少SO2排放 2CaCO3+2SO2 +O2 2CaSO4 +2CO2
2CaSO4 +2CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列实验装置设计正确、且能达到目的的是

A.实验I:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验III:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:海水的淡化
查看答案和解析>>
科目:高中化学 来源: 题型:
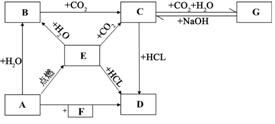
已知E为淡黄色固体,推断A-F各物
质时,下列说法正确的是:
A. C为碳酸氢钠。
B. E的俗称是硫磺。
C. B的俗称是苛性钠。
D. D代表水。
查看答案和解析>>
科目:高中化学 来源: 题型:
K2Cr2O7是一种常见的强氧化剂,酸性条件下会被还原剂还原成Cr3+。
(1)Cr3+能与OH-、CN-形成配合物[Cr(OH)4]-、[Cr(CN)6]3-。
① Cr3+的电子排布式可表示为________。
② [Cr(OH)4]-的结构式为(并标出配位键)________。
③ CN-与N2互为等电子体,写出CN-的电子式:________。
(2)K2Cr2O7能将乙醇氧化为乙醛,直至乙酸。
①乙醛中碳原子的杂化方式________、________。
②乙酸的沸点是117.9 ℃,甲酸甲酯的沸点是31.5 ℃,乙酸的沸点高于甲酸甲酯的沸点的主要原因是 。
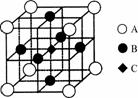
(3)一种新型阳极材料LaCrO3的晶胞如图所示,已知距离每个Cr原子最近的原子有6个,则图中________原子代表的是Cr原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com