
| ||
| ||


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
A、使酚酞呈红色的溶液中:Mg2+、Cl-、NO
| ||||
B、C(H+)=10-13 mol?L-1的溶液中:Na+、F--、NO
| ||||
| C、由水电离出的c(H+)=1×10-12 mol.L-1的溶液中:K+、Cl-、Rb+、Na+ | ||||
| D、澄清透明溶液中:K+、Cu2+、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
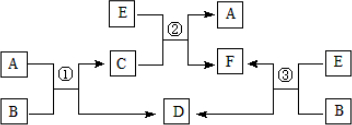
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100kPa |
5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
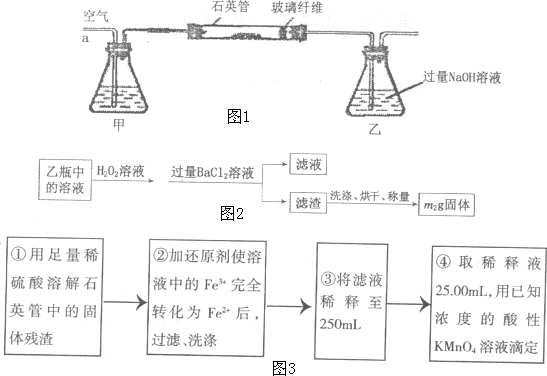
查看答案和解析>>
科目:高中化学 来源: 题型:
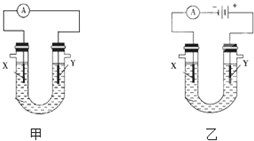
 工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10g NH3含有4NA个电子 |
| B、0.1mol铁和0.1mol铜分别与0.1mol氯气完全反应,转移的电子数均为0.2NA |
| C、标准状况下,22.4L H2O中分子数为NA个 |
| D、1L 0.1mol?L-1 Na2CO3溶液中含有0.1NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| B | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生产 | 铜离子可以氧化碘离子,白色沉淀可能为CuI |
| D | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com