
【题目】可逆反应C(s)+H2O(g)H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.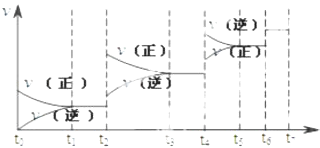
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
【答案】升高温度;增大压强;t3~t4
【解析】解:①该反应为体积增大的吸热反应,t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动,则改变条件为升高温度;
t4~t6段正逆速率都加快,且v(正)<v(逆),平衡逆向移动,则改变条件为增大压强;
②平衡正向移动,CO的含量升高,t2时升高温度平衡正向移动,至t3~t4平衡时含量达最高,t2时增大压强,平衡逆向移动,CO含量又减少;
故答案为:①升高温度;增大压强;②t3~t4;
①能使正逆反应速率增大的条件有:催化剂、升高温度、增大压强;结合平衡移动确定条件;
②要使混合物中CO的含量最高,则应为平衡正移后所达到的新的平衡点时候的浓度。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量一样多
B.需要加热才能发生的反应一定是吸热反应
C.在101kpa时,2gH2完全燃烧,生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣285.8kJ/mol
D.在强酸强碱稀溶液中:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为V(Z)= __________。
(3)2min反应达平衡,容器内混合气体的平均相对分子质量比起始时______(填增大、减小或不变);混合气体密度比起始时_______(填增大、减小或不变).
(4)将amolx与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
(5)下列措施能加快反应速率的是_________。
A.恒压时充入He;B.恒容时充入He;C.恒容时充入X;D.及时分离出Z;E.升高温度; F.选择高效的催化剂
(6)下列说法正确的是__________。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率加快,正反应速率大于逆反应速率
F.加入高效催化剂可加快正、逆反应速率,化学平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀(U)是一种稀有金属,制造氢弹的重要原料。提取铀涉及的反应为:UF4+ 2Mg![]() U + 2MgF2。在该反应中,作为还原剂的物质是______,被还原的物质是______;若反应中消耗1 mol Mg,则生成U______mol。
U + 2MgF2。在该反应中,作为还原剂的物质是______,被还原的物质是______;若反应中消耗1 mol Mg,则生成U______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞中各种化合物占细胞鲜重的含量,按从多到少的顺序排列,正确的是( )
A.水、蛋白质、糖类、脂质 B.蛋白质、糖类、脂质、水
C.蛋白质、水、脂质、糖类 D.水、蛋白质、脂质、糖类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O所含的电子数为10NA
B. 1 mol H2O2中含有极性键的数目为3NA
C. 标准状况下,22.4 L四氯化碳所含分子数为NA
D. 32g O2和O3的混合物中含有的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液与人类生活息息相关,请回答下列问题
(1)某温度下,Kw=1×10﹣12( molL﹣1)2 , 若保持温度不变,向水中滴入稀硫酸恰好使溶液中c(H+)/c(OH﹣)=1×1010 , 则此时水电离出的c(H+)=molL﹣1 .
(2)常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是 .
A.若混合后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7mol/L
B.若V1=V2 , 混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)下列曲线中,可以描述乙酸(甲,Ka=1.8×10﹣5 mol/L)和一氯乙酸(乙,Ka=1.4×10﹣3 mol/L)在水中的电离度与浓度关系的是 . 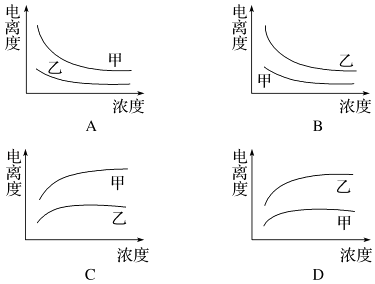
(4)在下列实验中,能证明醋酸酸性比盐酸酸性弱的是 .
A.将等体积、pH=4的盐酸和醋酸稀释成pH=5的溶液,测量所需加入水量的多少
B.向等体积、等pH的盐酸和醋酸中分别加入同量的相应钠盐固体,测溶液的pH有无变化
C.向等体积、等浓度的盐酸和醋酸分别加入足量锌粉,测量产生氢气的体积
D.用等体积、等浓度的盐酸和醋酸做导电性实验,根据灯泡的明亮程度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。负极电极反应式为___________________________________________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu===2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为________,当线路中转移0.2 mol电子时,则被腐蚀铜的质量为________g。
(3)燃料电池是一种高效、环境友好的供电装置,以甲醇做燃料的电池,如下图所示,

①负极反应物是______________,H+从________极到________极(填a或b)。
②正极反应式为_________________,负极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com