
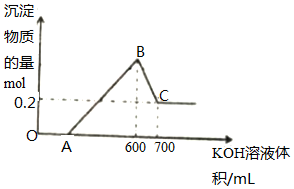
 将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:分析 由图可知,从开始至加入KOH溶液到A,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2KOH=K2SO4+2H2O;继续滴加KOH溶液,到氢氧化钾溶液为600mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为硫酸钾溶液.再继续滴加KOH溶液,氢氧化铝与氢氧化钾反应生成偏铝酸钾与水,发生反应Al(OH)3+KOH=KAlO2+2H2O,据此进行解答.
解答 解:由图可知,从开始至加入KOH溶液到A,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2KOH=K2SO4+2H2O;继续滴加KOH溶液,到氢氧化钾溶液为600mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,发生反应:3OH-+Al3+=Al(OH)3↓,2OH-+Mg2+=Mg(OH)2↓,溶液为硫酸钾溶液.再继续滴加KOH溶液,氢氧化铝与氢氧化钾反应生成偏铝酸钾与水,发生反应Al(OH)3+KOH=KAlO2+2H2O,沉淀部分溶解.
(1)OA段,氢氧化钾与硫酸反应生成硫酸钾和水,离子方程式:H++OH-=H2O;BC段,继续滴加KOH溶液,氢氧化铝与氢氧化钾反应生成偏铝酸钾与水,发生反应Al(OH)3+KOH=KAlO2+2H2O,离子方程式:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:H++OH-=H2O; Al(OH)3+OH-=AlO2-+2H2O;
(2)硫酸的物质的量为:0.3L×4mol/L=1.2mol,B点溶液为硫酸钾溶液,依据2K+~SO42-,则钾离子物质的量为2.4mol,即加入氢氧化钾物质的量为2.4mol,则氢氧化钾物质的量浓度为:2.4mol÷0.6L=4mol/L;
混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体,物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,由2Al~3H2↑,可知铝的物质的量为0.2mol,BC段消耗氢氧化钾物质的量为:0.1L×4mol/L=0.4mol,发生反应:Al(OH)3+OH-=AlO2-+2H2O,可知氢氧化铝物质的量为0.4mol,依据铝原子个数守恒,含有氧化铝的物质的量为:$\frac{0.4-0.2}{2}$=0.1mol;
故答案为:4;0.1;
(3)依据加入700mL氢氧化钾后沉淀物质的量为0.2mol,得溶液中含镁离子物质的量为0.2mol,沉淀镁离子消耗0.4mol氢氧化钾,沉淀0.4mol铝离子需要消耗氢氧化钾物质的量为0.4mol×3=1.2mol,所以OA段消耗氢氧化钾物质的量为:0.6L×4mol/L-0.4mol-1.2mol=0.8mol,消耗氢氧化钾体积:$\frac{0.8mol}{4mol/L}$=0.2L,即200mL;
故答案为:200;
(4)检验钾离子可以用焰色反应,透过蓝色钴玻璃观察,火焰呈紫色;
故答案为:透过蓝色钴玻璃观察,火焰呈紫色;
(5)C点溶液为偏铝酸钾溶液,通入足量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钾,反应的离子方程式:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查镁铝的重要化合物及计算,为高频考点,把握图象各阶段的物质的量的关系及各阶段的化学反应为解答的关键,注意反应的先后顺序及利用守恒计算,侧重分析与计算能力的考查,题目难度中等.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
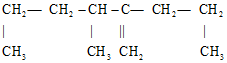 有机物,其正确命名应是( )
有机物,其正确命名应是( )| A. | 2,3-二丙基-1-丁烯 | B. | 2-丙基-3,5-二甲基-1-戊烯 | ||
| C. | 3-甲基-2-丙基-1-己烯 | D. | 3,5-二甲基-2-丙基-1-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
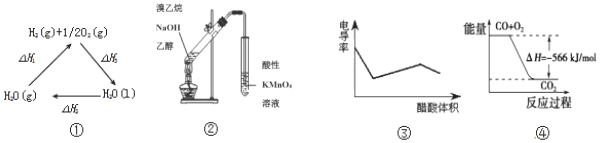
| A. | 图①中△H1=△H2+△H3 | |
| B. | 图②可用于证明实验中生成了乙烯 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
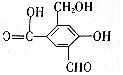 ,试回答下列问题:
,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com