
【题目】活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:

一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
pH | 3.2 | 6.7 | 8.0 | 9.7 |
(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是_____________________________。
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。先加入___________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2,,经检测溶液中Fe2+的浓度为0.009mol·L-1,则每升溶液中至少应加入__________mol KMnO4。
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是___________。
(4)“沉淀”后所得“滤渣”的成分为ZnCO3·2Zn(OH)2·H2O,其在450~500℃下进行“煅烧”,“煅烧”反应的化学方程式为____________________________。
【答案】增大固液接触面积,加快溶解时的反应速率 Na2CO3 0.003 锌粉 ZnCO3·2Zn(OH)2·H2O![]() 3ZnO+CO2↑+3H2O↑
3ZnO+CO2↑+3H2O↑
【解析】
制备活性氧化锌流程为:氧化锌粗品中加入稀硫酸,氧化锌、铁的氧化物、氧化铜与稀硫酸反应,通过过滤操作分离出滤渣,滤液中含有铁离子、亚铁离子、锌离子、铜离子,酸化滤液后加入适量碳酸钠溶液得到沉淀ZnCO3·2Zn(OH)2·H2O,经过煅烧得到ZnO,据此解答。
(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率。
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质,先加入Na2CO3调节溶液的pH至5.4,使溶液的酸性减弱,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2,在KMnO4中锰元素的化合价降低,该反应中作为氧化剂,反应的离子方程式为MnO4-+3Fe2++7H2O=MnO2+3Fe(OH)3↓+5H+。经检测溶液中Fe2+的浓度为0.009mol·L-1,即1L溶液中亚铁离子的物质的量是0.009mol,则依据方程式可知消耗高锰酸钾是0.003mol,所以每升溶液中至少应加入0.003mol KMnO4。
(3)由于制备活性氧化锌,杂质Cu2+可利用置换反应除去,不能引入杂质,所以应选择的试剂是锌粉;
(4)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500℃下进行,根据原子守恒可知“煅烧”反应的化学方程式为ZnCO3·2Zn(OH)2·H2O![]() 3ZnO+CO2↑+3H2O↑。
3ZnO+CO2↑+3H2O↑。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】海水是自然赐给人类的宝藏,海水的综合利用是全世界研究的重点。完成下列问题:
(1)粗盐中除了含有泥沙之外还含有Ca2+、Mg2+、SO42-等杂质,粗盐获得精盐一般步骤如下:

加入的试剂①、②分别是:_________、_________。
(2)某学生在实验室中模拟海水提取溴的步骤为:
取25 L除去悬浮杂质后的海水,浓缩至2L,向其中通入足量氯气。
① 氧化步骤中生成Br2的离子方程式为_______________________________。
② 将吹出的Br2(g)用纯碱溶液全部吸收,发生反应:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑ ,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀。计算海水中溴的浓度为_______g/L。
③实验室中若用CCl4提取少量的溴:向溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液,该分离提纯溴的方法叫________;用到的主要仪器为_____________。
(3)实验证明金属制品在海水中更容易生锈,铜锈的化学式为: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是()
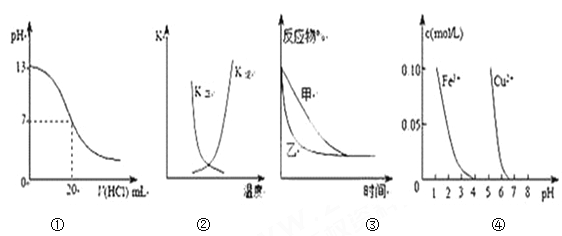
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2A(g) + B(g)![]() 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
C. 图③表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙压强比甲压强大
3C(g)+D(s)的影响,乙压强比甲压强大
D. 据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O=CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是_______(用元素符号填写)。
(2)氧和硫属于同族元素,写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________________________________。
(3)NaOH的电子式为______________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式______________。
(5)钠一钙联合处理法的优点有________________。(任写一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,则BeCl2属于( )
A. 由极性键构成的极性分子B. 由极性键构成的非极性分子
C. 由非极性键构成的极性分子D. 由非极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2A(g)+B(g)![]() 3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
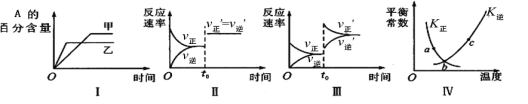
A.图I表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻缩小容器体积对反应速率的影响
C.图Ⅲ表示t0时刻增大B浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() Z(g)+W(s);△H>0下列叙述正确的是( )
Z(g)+W(s);△H>0下列叙述正确的是( )
A. 加入少量W,逆反应速率增大 B. 当容器中气体密度不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某基态原子的外围电子排布式为4d15s2,则下列说法正确的是()
A. 该元素基态原子中共有3个电子
B. 该元素原子核外有5个电子层
C. 该元素原子最外层共有3个电子
D. 该元素原子M能层共有8个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com