
(08年上海卷)在一定的条件下,完全分解下列某化合物2g,产生氧气1.6g,此化合物是( )
![]()
科目:高中化学 来源: 题型:
(08年上海卷)(B类卷)某实验小组用下列装置进行乙醇催化氧化的实验。
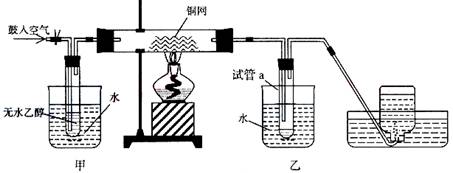
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式______________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是______反应。
(2)甲和乙两个水浴作用不相同。甲的作用是_____________;乙的作用是___________________。
(3)反应进行一段时间后,干燥管a中能收集到不同的物质,它们是___________。集气瓶中收集到的气体的主要成分是____________。
(4)若试管a中收集到的液体用紫色石蕊试纸,试纸显红色,说明液体中还有____________。要除去该物质,可先在混合液中加入_________(填写字母)。a、氯化钠溶液;b、苯;c、碳酸氢钠溶液 d、四氯化碳;然后再通过___________(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年上海卷)已知: 物质A在体内脱氢酶的作用下会氧化为有害物质GHB。下图是关于物质A的一种制备方法及由A引发的一系列化学反应。
![]()
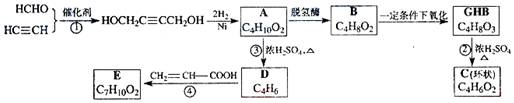
请回答下列问题:
(1)写出反应类型:反应①____________,反应②____________。
(2)写出化合物B的结构简式_____________________________。
(3)写出反应②的化学方程式____________________________。
(4)写出反应④的化学方程式____________________________。
(5)反应④中除生成E外,还可能存在一种副产物(含![]() 结构),它的结构简式为________________。
结构),它的结构简式为________________。
(6)与化合物E互为同分异构体的物质不可能为________(填写字母)。
a、醇 b、醛 c、羧酸 d、酚
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年上海卷)植物及其废弃物可以制取乙醇燃料,下列关于乙醇燃料的说法错误的是 ( )
A.它是一种再生能源 B.乙醇易燃烧,污染小
C.乙醇只能在实验室内作燃料 D.粮食作物是制乙醇的重要原料
查看答案和解析>>
科目:高中化学 来源: 题型:
(06年上海卷)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_____________________,
K值大小与温度的关系是:温度升高,K值________________________(填一定增大、一定减小、或可能增大也可能减小)。
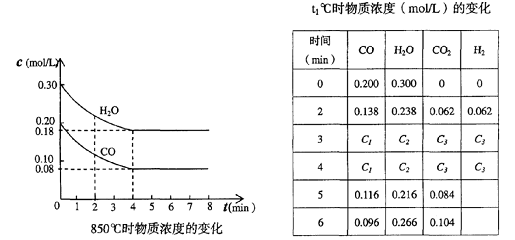
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) ![]() CO2(g)十H2 (g)十Q(Q>0)
CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如下图,则0―4min的平均反应速率v(CO)=______ mol/(L?min)

(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min―4min之间反应处于____________状态;
C1数值____________0.08 mol/L (填大于、小于或等于)。
②反应在4min―5min问,平衡向逆方向移动,可能的原因是____________(单选),
表中5min―6min之间数值发生变化,可能的原因是______________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
(06年上海卷)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_____________________,
K值大小与温度的关系是:温度升高,K值________________________(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) ![]() CO2(g)十H2 (g)十Q(Q>0)
CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如下图,则0―4min的平均反应速率v(CO)=______ mol/(L?min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min―4min之间反应处于____________状态;
C1数值____________0.08 mol/L (填大于、小于或等于)。
②反应在4min―5min问,平衡向逆方向移动,可能的原因是____________(单选),
表中5min―6min之间数值发生变化,可能的原因是______________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com