
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
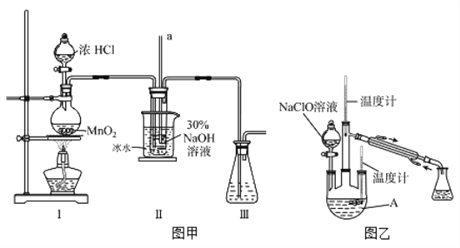
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为____。
【答案】 BD MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 平衡压强 防止NaClO分解为NaCl和NaClO3,影响水合肼的产率 2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O 淀粉溶液 25%
Mn2++Cl2↑+2H2O 平衡压强 防止NaClO分解为NaCl和NaClO3,影响水合肼的产率 2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O 淀粉溶液 25%
【解析】分析:本题考查质量分数溶液的配制、NaClO溶液和水合肼的制备、Cl2的实验室制备、肼含量的测定、指定情境下方程式的书写。
【制备NaClO溶液】图甲装置I中MnO2与浓盐酸共热制Cl2;根据“已知3NaClO![]() 2NaCl+NaClO3”,说明NaClO受热易分解,装置II中Cl2与NaOH溶液在冰水浴中制备NaClO溶液;Cl2有毒,装置III用于吸收多余Cl2,防止污染大气。
2NaCl+NaClO3”,说明NaClO受热易分解,装置II中Cl2与NaOH溶液在冰水浴中制备NaClO溶液;Cl2有毒,装置III用于吸收多余Cl2,防止污染大气。
【制备水合肼】由于水合肼具有强还原性,NaClO具有强氧化性,NaClO溶液滴加过快,NaClO将部分水合肼氧化成N2,NaClO被还原成NaCl。
【测定肼的含量】反应中用碘水滴定肼溶液,所以用淀粉溶液作指示剂。根据消耗的I2和方程式计算N2H4·H2O的质量,进一步计算N2H4·H2O的质量分数。
详解:【制备NaClO溶液】(1)配制30%NaOH溶液的实验步骤为:计算、称量、溶解,所需的玻璃仪器有:量筒、烧杯、玻璃棒,答案选BD。
(2)图甲装置I中MnO2与浓HCl共热制备Cl2,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,反应的离子方程式为MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。II中玻璃管a的作用为:平衡压强。装置II中Cl2与NaOH溶液反应制备NaClO溶液,根据“已知3NaClO
Mn2++Cl2↑+2H2O。II中玻璃管a的作用为:平衡压强。装置II中Cl2与NaOH溶液反应制备NaClO溶液,根据“已知3NaClO![]() 2NaCl+NaClO3”,说明NaClO受热易分解,为了防止NaClO分解,使用冰水浴降低温度。II中用冰水浴控制温度在30℃以下,其主要目的是:防止NaClO分解生成NaCl和NaClO3,影响水合肼的产率。
2NaCl+NaClO3”,说明NaClO受热易分解,为了防止NaClO分解,使用冰水浴降低温度。II中用冰水浴控制温度在30℃以下,其主要目的是:防止NaClO分解生成NaCl和NaClO3,影响水合肼的产率。
【制备水合肼】(3)图乙的分液漏斗中为NaClO溶液,水合肼具有强还原性,NaClO具有强氧化性,若滴加速率过快,溶液中有过多的NaClO,水合肼参与反应被氧化成N2,NaClO被还原成NaCl,根据得失电子守恒和原子守恒,相关反应的化学方程式为2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O。
【测定肼的含量】①滴定时反应原理为2I2+N2H4·H2O=N2↑+4HI+H2O,使用标准碘水溶液,可选用的指示剂为淀粉溶液。滴定终点的现象为:滴入最后一滴I2溶液,溶液变为蓝色且在30s内不褪去。
②20.00mL溶液中n(N2H4·H2O)=![]() n(I2)=
n(I2)=![]() 0.1500mol/L
0.1500mol/L![]() 0.02L=0.0015mol,馏分中m(N2H4·H2O)=0.0015mol
0.02L=0.0015mol,馏分中m(N2H4·H2O)=0.0015mol![]() 50g/mol=0.075g,馏分中N2H4·H2O的质量分数为
50g/mol=0.075g,馏分中N2H4·H2O的质量分数为![]() 100%=25%。
100%=25%。


科目:高中化学 来源: 题型:
【题目】下面是比较过氧化钠和氧化钠性质异同的有关叙述,其中错误的是( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠是一种碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)指出下图所表示的共价键名称,并列举含有该共价键的一种物质,写出其分子式。

共价键名称 举例
①__________,__________;
②__________,__________;
③__________,__________;
④__________,__________;
⑤__________,__________。
(2)某有机物分子的结构简式为CH2=CHCOOH,该分子中有________个σ键,________个π键,有__________种极性键,__________(填“有”或“没有”)非极性键。
(3)用电子式表示Cl2、NH3、H2S、CO2分子的形成过程________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为__________。
(2)在化合物YZ2中Y的化合价为__________;Y2-与Na+的半径大小为__________。
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是__________;X与Y的第一电离能:X__________Y(填“<”、“>”或“=”),其理由是__________________________________________________________。
【答案】 ![]() +2 O2->Na+ F>O>N > N原子的p轨道为半充满,能量低较稳定,难失电子
+2 O2->Na+ F>O>N > N原子的p轨道为半充满,能量低较稳定,难失电子
【解析】试题分析:X、Y、Z、R、W、J是前五周期的元素,其中J为0族元素,所以X、Y、Z、R、W、J分别是N、O、F、S、Br、Xe;
解析:(1)R是S元素,原子的电子排布图为![]() 。
。
(2)化合物YZ2是OF2,F元素的化合价是-1,所以O元素的化合价为+2;O2-与Na+都有2个电子层,钠的质子数大于氧,所以半径大小为O2->Na+ 。
(3)同周期元素从左到右电负性增大,所以在N、O、F三种元素中,电负性由大到小的顺序是F>O>N;N原子2p能级半充满,能量低较稳定,第一电离能大于相邻的氧元素,N与O的第一电离能:N>O。
【题型】综合题
【结束】
22
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为__________,K的元素名称为__________。
(2)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布式________________。
(3)下列对比正确的是__________。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答下列问题:
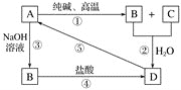
(1)写出化学式:A是____________,D是____________。
(2)写出相关反应的化学方程式:①____________,⑤____________。
(3)写出相关反应的离子方程式:②__________,③__________,④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“物质的量”“摩尔”和“摩尔质量”的叙述正确的是( )
A.“物质的量”是国际单位制中的个基本单位
B.1mol任何物质均约含有6.02×1023个分子
C.物质的摩尔质量等于其相对分子质量或相对原子质量
D.0.012kg12C中所含的碱原子数为NA(NA代表阿伏加德罗常数的数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,正确的是

A. 装置①不可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室可用装置③收集HCl
D. 验证溴乙烷发生消去反应生成烯烃的实验可利用装置④进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
A.空气、天然气、苛性钾、石灰石B.液氯、氯水、硫酸钠、乙醇
C.盐酸、水煤气、醋酸、干冰D.胆矾、漂白粉、氯化钾、氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,原子半径依次增大。W、X在同一主族,Y元素在第三周期中离子半径最小,Y和Z的原子序数之和是W的3倍。下列说法正确的是
A. X的简单氢化物的热稳定性比W的强 B. X的氧化物对应的水化物是强酸
C. Z和W形成的化合物可能含有非极性键 D. Z、Y的氧化物是常用的耐火材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com