

| A. | 操作II中,通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化 | |
| B. | 在溶液中用硫酸酸化至pH=2的目的防止Fe2+沉淀 | |
| C. | 操作Ⅰ所得滤液中可能含有Fe3+ | |
| D. | 常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe2+的含量,滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O |
分析 铁屑(含少量锡、氧化铁等杂质)与稀硫酸反应生成硫酸锡和硫酸亚铁,通过过滤滤去不溶的物质,通过调节溶液的PH并通入硫化氢使锡离子沉淀,过滤除去不溶性的硫化锡,得到硫酸亚铁溶液通过冷却结晶,得到纯净绿矾;
A、通入硫化氢至饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;
B、根据SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,可知用硫酸酸化后调节溶液PH=2目的是锡离子完全沉淀,亚铁离子不沉淀;
C、稀硫酸是弱氧化剂,只能将铁氧化为亚铁;
D、高锰酸钾是氧化剂,而亚铁离子是还原剂,两者发生氧化还原反应,根据电子得失守恒书写离子反应方程式.
解答 解:铁屑(含少量锡、氧化铁等杂质)与稀硫酸反应生成硫酸锡和硫酸亚铁,通过过滤滤去不溶的物质,通过调节溶液的PH并通入硫化氢使锡离子沉淀,过滤除去不溶性的硫化锡,得到硫酸亚铁溶液通过冷却结晶,得到纯净绿矾;
A、通入硫化氢至饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化,所以通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化,故A正确;
B、根据SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,而PH=2在1.6和3.0之间,所以锡离子完全沉淀,亚铁离子不沉淀,故B正确;
C、稀硫酸是弱氧化剂,只能将铁氧化为亚铁,不可能生成铁离子,故C错误;
D、高锰酸钾是氧化剂,而亚铁离子是还原剂,两者发生氧化还原反应,根据电子得失守恒,锰由+7→+2,降低5,而铁元素由+2→+3,升高1,所以亚铁离子前面系数为5,再根据原子守恒和电荷守恒,方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,故D正确;
故选C.
点评 本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑧ | ⑨ | ⑩ |
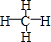 ;其中心原子采取sp3杂化,空间构型为正四面体.
;其中心原子采取sp3杂化,空间构型为正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能和NaOH溶液反应 | |
| B. | 甲苯与液溴,铁作催化剂的反应 | |
| C. | 甲苯能被酸性高锰酸钾氧化 | |
| D. | 1mol邻二甲苯与3mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 定容加水超过刻度线又吸出少量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
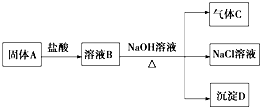
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
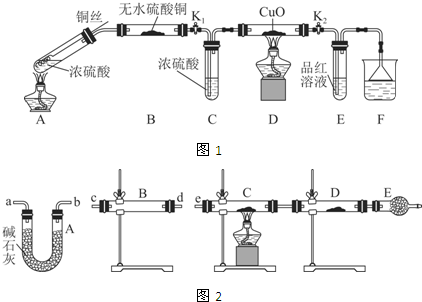
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH | |
| B. | 实验时受溴腐蚀致伤,先用苯或甘油洗伤口,再用水洗 | |
| C. | 可用重结晶法提纯含少量NaCl的KNO3晶体 | |
| D. | 容量瓶、滴定管上都标有使用温度,容量瓶无“O”刻度,滴定管有“O”刻度,使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com