
| A. | 44 g由CO2和N20组成的混合气体中的氧原子数为2NA | |
| B. | 1 mol由异丁烷和正丁烷组成的混合物中含有的共价键数目为13NA | |
| C. | 2 mol SO2与2 molO2充分反应生成的SO2分子数为NA | |
| D. | 100 mL 12 mol•L-1浓盐酸与足量MnO2反应,转移的电子数为0.6NA |
分析 A、CO2和N2O的摩尔质量均为44g/mol,但二氧化碳中含2个氧原子,而N20中含一个氧原子;
B、异丁烷和正丁烷中均含13条共价键;
C、二氧化硫和氧气的反应为可逆反应;
D、二氧化锰只能与浓盐酸反应,和稀盐酸不反应.
解答 解:A、CO2和N2O的摩尔质量均为44g/mol,故44g两者的混合物的物质的量为1mol,但二氧化碳中含2个氧原子,而N2O中含一个氧原子,故1mol混合物中含有的氧原子的个数介于NA个和2NA个之间,故A错误;
B、异丁烷和正丁烷中均含13条共价键,故1mol两者的混合物中含有的共价键个数为13NA条,故B正确;
C、二氧化硫和氧气的反应为可逆反应,不能反应完全,故生成的二氧化硫分子个数小于NA个,故C错误;
D、二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故盐酸不能反应完全,则转移的电子数小于0.6NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| C | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C | B. | A>C>B | C. | C>B>A | D. | B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
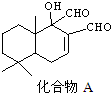 科学家研制出多种新型杀虫剂,以代替DDT.如图所示的化合物A就是其中的一种,下列关于化合物A的说法中正确的是( )
科学家研制出多种新型杀虫剂,以代替DDT.如图所示的化合物A就是其中的一种,下列关于化合物A的说法中正确的是( )| A. | 化合物A的分子式是C15H22O3 | |
| B. | 化合物A是芳香族化合物 | |
| C. | 化合物A可以发生卤代反应、酯化反应和银镜反应 | |
| D. | 1mol化合物A最多可与1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
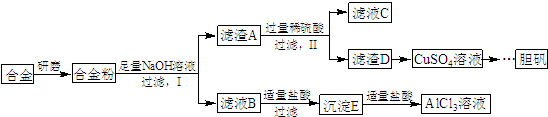
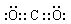 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某盐溶液中加入AgNO3溶液,产生白色沉淀;加入浓NaOH溶液加热,生成使湿润红色石蕊试纸变蓝的气体 | 该盐一定是NH4Cl |
| B | 向浓硝酸中加入足量铜片充分反应,所得气体显红棕色 | 该气体是纯净的NO2 |
| C | 常温下,向浓度均为0.01mol/L的Na2CO3和Na2SO4的混合溶液中滴加1~2滴BaCl2溶液,滤出的沉淀不溶于盐酸 | 说明常温下Ksp(BaCO3)>Ksp(BaSO4) |
| D | 向Na2O2与水反应后所得溶液中加少量MnO2 | 检验Na2O2与水反应的中 间产物为H2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 使用高效催化剂只能提高正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率为零 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①② | B. | ②①③ | C. | ③②① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com