
下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
科目:高中化学 来源: 题型:
关于乙醇的说法不正确的是( )
A.乙醇是具有特殊气味的液体
B.乙醇分子里含有6个氢原子,它们的性质是完全一样的
C.乙醇易挥发,与水任意比互溶
D.乙酸的熔沸点比乙醇高
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中不能大量共存的离子组是( )
①NH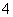 、Ag+、PO
、Ag+、PO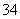 、Cl-
、Cl-
②Fe3+、H+、I-、HCO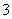
③Al3+、Mg2+、SO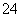 、CO
、CO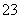
④在pH=12的溶液中,K+、Cl-、HCO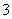 、Na+
、Na+
⑤在pH=0的溶液中,Na+、NO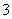 、SO
、SO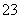 、K+
、K+
A.仅①③④ B.仅①②③
C.全部 D.仅①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH 、Cl-、S2-
、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO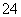 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO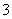
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO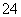
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO(g) | CO2(g) | NaOH溶液、 浓H2SO4 | 洗气 |
| B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C. | Cl2(g) | HCl(g) | 饱和食盐水、 浓H2SO4 | 洗气 |
| D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活息息相关,下列叙述错误的是( )
A.铁表面镀锌可增强其抗腐蚀性
B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.含重金属离子的电镀废液不能随意排放
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如图K72所示。
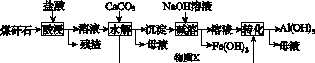
图K72
(1)写出“酸浸”过程中主要反应的离子方程式:
________________________________________________________________________、
________________________________________________________________________。
(2)“酸浸”时铝浸出率的影响因素可能有________________、________________。(写出2个)
(3)物质X的化学式为________。“碱溶”时反应的离子方程式为__________________________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。
为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O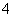 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com